
| 1 |
| 4 |
| 1 |
| 4 |
| 8bV | ||
|
| 8000bV |
| a |
| 8000bV |
| a |


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
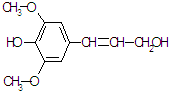 膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示.下列有关说法正确的是( )
膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示.下列有关说法正确的是( )| A、芥子醇的分子式是C11H16O4 |
| B、芥子醇分子中所有碳原子不可能在同一平面 |
| C、芥子醇能与3mol溴水反应 |
| D、芥子醇能发生的反应类型有氧化、取代、加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.| 滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | V |  |  | 见① |
| 2 | V | 0.50 | 30.8 | 30.30 |
| 3 | V | 6.00 | 36.35 | 30.35 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| n(Cl2) |
| n(SO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
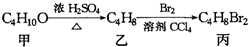 ,丙的结构简式不可能是( )
,丙的结构简式不可能是( )| A、CH3CH(CH2Br)2 |
| B、(CH3)2CBrCH2Br |
| C、C2H5CHBrCH2Br |
| D、CH3(CHBr)2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从开始反应到达平衡,所需时间tA>tB |
| B、平衡时,I2蒸气在混合气体中的体积分数φA>φB |
| C、平衡时,I2蒸气的物质的量浓度[I2]A=[I2]B |
| D、HI的平衡转化率,αA=αB |
查看答案和解析>>
科目:高中化学 来源: 题型:
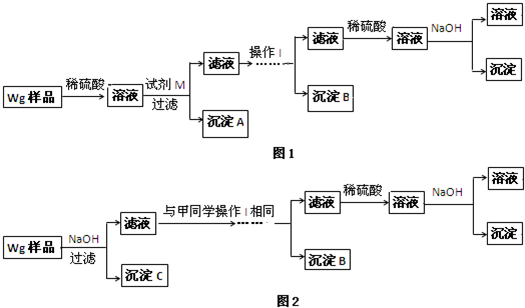
查看答案和解析>>
科目:高中化学 来源: 题型:
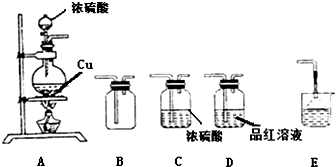
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com