
| 物质 | H2 | CO | CH3OH |
| 浓度/mol•L-1 | 0.2 | 0.1 | 0.4 |
分析 ①计算此时的浓度商Qc,与平衡常数比较,判断反应进行的方向,据此解答;
②依据图表数据计算起始量,结合三段式列式计算,根据甲氢气的浓度变化计算甲醇的浓度变化量,再根据v=$\frac{△C}{△t}$计算v(CH3OH).
解答 解:①由表中数据可知,10min时氢气的浓度为0.2mol/L、CO的浓度为0.1mol/L、甲醇的浓度为0.4mol/L,则此时的浓度商Qc=$\frac{0.4}{0.{2}^{2}×0.1}$=100,小于平衡常数160,故反应向正反应方向进行,故V正>V逆,故答案为:>;
②依据图表可知和H2和CO的起始物质的量浓度分别为1mol/L和0.5mol/L.
2H2(g)+CO(g)?CH3OH(g)
起始量(mol/L) 1 0.5 0
变化量(mol/L) 0.8 0.4 0.4
T4时(mol/L) 0.2 0.1 0.4
若T1℃反应10min达到平衡,c(H2)=0.4mol•L-1,由表中数据可知,l0min内氢气的浓度变化量为0.6mol/L,故甲醇的浓度变化量为0.3mol/L,故v(CH3OH)=$\frac{0.3mol/L}{10min}$=0.03mol/(L•min),
故答案为:0.03mol/(L•min).
点评 本题考查了化学平衡的有关计算、化学平衡常数及应用等,难度不大,注意掌握平衡常数应用.


 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | K+、H+、SO42-、OH- | B. | Na+、H+、Cl-、CO32- | ||
| C. | Na+、Ca2+、CO32-、NO3- | D. | K+、Cu2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,E元素的电子排布式为1s22s22p63s23p63d5s4s1.
,E元素的电子排布式为1s22s22p63s23p63d5s4s1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L的NaCl溶液是指此溶液中含有1 mol NaCl | |
| B. | 从1L 0.5mo1/L的NaCl溶液中取出100 mL溶液,其物质的量浓度变为0.1mol/L | |
| C. | 0℃时,1molC12的体积约为22.4L | |
| D. | 1mol/L的CaCl2溶液中,Cl-的物质的量浓度为2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
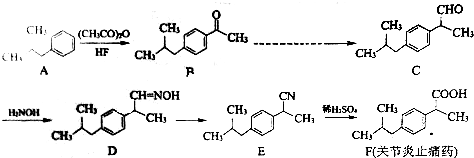
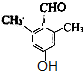 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铁制容器可盛装冷的浓硫酸,因为常温下铁和浓硫酸不反应 | |
| B. | Na2O2用作呼吸面具的供氧剂 | |
| C. | 欲鉴别FeCl2溶液、AlCl3溶液和AgNO3溶液,向3种待测液中分别滴加足量氨水 | |
| D. | 铝热反应需提供一定的能量引发,因为铝热反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
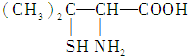
| A. | 青霉氨基酸分子中所有碳原子均在同一直线上 | |
| B. | 青霉氨基酸具有两性并能发生酯化反应 | |
| C. | 青霉氨基酸分子间不能发生缩合反应 | |
| D. | 1 mol青霉氨基酸与足量的金属钠反应生成0.5 mol H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com