
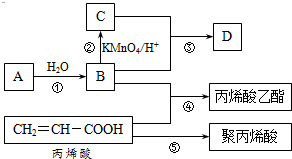
 A”¢B”¢C”¢DŹĒĖÄÖÖ³£¼ūµÄÓŠ»śĪļ£¬ĘäÖŠAŹĒŅ»ÖÖĘųĢ¬Ģž£¬ŌŚ±ź×¼×“æöĻĀµÄĆܶČĪŖ1.25g/L£»BÓėCŌŚÅØĮņĖįŗĶ¼ÓČČĢõ¼žĻĀ·¢Éś·“Ó¦£¬Éś³ÉµÄÓŠ»śĪļÓŠĢŲŹāĻćĪ¶£»A”¢B”¢C”¢DŌŚŅ»¶ØĢõ¼žĻĀµÄ×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾v£Ø·“Ó¦Ģõ¼žŅŃŹ”ĀŌ£©£ŗ
A”¢B”¢C”¢DŹĒĖÄÖÖ³£¼ūµÄÓŠ»śĪļ£¬ĘäÖŠAŹĒŅ»ÖÖĘųĢ¬Ģž£¬ŌŚ±ź×¼×“æöĻĀµÄĆܶČĪŖ1.25g/L£»BÓėCŌŚÅØĮņĖįŗĶ¼ÓČČĢõ¼žĻĀ·¢Éś·“Ó¦£¬Éś³ÉµÄÓŠ»śĪļÓŠĢŲŹāĻćĪ¶£»A”¢B”¢C”¢DŌŚŅ»¶ØĢõ¼žĻĀµÄ×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾v£Ø·“Ó¦Ģõ¼žŅŃŹ”ĀŌ£©£ŗ £¬CÖŠ¹ŁÄÜĶŵÄĆū³ĘĪŖōČ»ł£®
£¬CÖŠ¹ŁÄÜĶŵÄĆū³ĘĪŖōČ»ł£® £¬¼Ó¾Ū·“Ó¦£®
£¬¼Ó¾Ū·“Ó¦£® ·ÖĪö A”¢B”¢C”¢DŹĒĖÄÖÖ³£¼ūµÄÓŠ»śĪļ£¬ĘäÖŠAŹĒŅ»ÖÖĘųĢ¬Ģž£¬ŌŚ±ź×¼×“æöĻĀµÄĆܶČĪŖ1.25g/L£¬ĘäĦ¶ūÖŹĮæ=1.25g/L”Į22.4L/mol=28g/mol£¬
BŗĶ±ūĻ©Ėį·¢Éśõ„»Æ·“Ӧɜ³É±ūĻ©ĖįŅŅõ„£¬ŌņBĪŖCH3CH2OH£¬B±»ĖįŠŌøßĆĢĖį¼ŲČÜŅŗŃõ»ÆÉś³ÉCĪŖCH3COOH£¬BÓėCŌŚÅØĮņĖįŗĶ¼ÓČČĢõ¼žĻĀ·¢Éś·“Ó¦£¬Éś³ÉµÄÓŠ»śĪļÓŠĢŲŹāĻćĪ¶£¬ŌņDĪŖCH3COOCH2CH3£»
ŅŅĻ©ŗĶĖ®·¢Éś¼Ó³É·“Ӧɜ³ÉŅŅ“¼£¬ŌņAĪŖCH2=CH2£»
±ūĻ©Ėį·¢Éś¼Ó¾Ū·“Ӧɜ³É¾Ū±ūĻ©Ėį£¬ŌŁ½įŗĻĢāÄæ·ÖĪö½ā“š£®
½ā“š ½ā£ŗA”¢B”¢C”¢DŹĒĖÄÖÖ³£¼ūµÄÓŠ»śĪļ£¬ĘäÖŠAŹĒŅ»ÖÖĘųĢ¬Ģž£¬ŌŚ±ź×¼×“æöĻĀµÄĆܶČĪŖ1.25g/L£¬ĘäĦ¶ūÖŹĮæ=1.25g/L”Į22.4L/mol=28g/mol£¬
BŗĶ±ūĻ©Ėį·¢Éśõ„»Æ·“Ӧɜ³É±ūĻ©ĖįŅŅõ„£¬ŌņBĪŖCH3CH2OH£¬B±»ĖįŠŌøßĆĢĖį¼ŲČÜŅŗŃõ»ÆÉś³ÉCĪŖCH3COOH£¬BÓėCŌŚÅØĮņĖįŗĶ¼ÓČČĢõ¼žĻĀ·¢Éś·“Ó¦£¬Éś³ÉµÄÓŠ»śĪļÓŠĢŲŹāĻćĪ¶£¬ŌņDĪŖCH3COOCH2CH3£»
ŅŅĻ©ŗĶĖ®·¢Éś¼Ó³É·“Ӧɜ³ÉŅŅ“¼£¬ŌņAĪŖCH2=CH2£»
±ūĻ©Ėį·¢Éś¼Ó¾Ū·“Ӧɜ³É¾Ū±ūĻ©Ėį£¬
£Ø1£©AŹĒŅŅĻ©£¬ŅŅĻ©·Ö×Óµē×ÓŹ½ĪŖ £¬CŹĒŅŅĖį£¬ŅŅĖįÖŠ¹ŁÄÜĶÅĆū³ĘŹĒōČ»ł£¬
£¬CŹĒŅŅĖį£¬ŅŅĖįÖŠ¹ŁÄÜĶÅĆū³ĘŹĒōČ»ł£¬
¹Ź“š°øĪŖ£ŗ £»ōČ»ł£»
£»ōČ»ł£»
£Ø2£©a£®±ūĻ©ĖįÖŠĢ¼Ģ¼Ė«¼üÄܼӳɷ“Ó¦£¬¹ŹÕżČ·£»
b£®±ūĻ©ĖįÖŠōČ»łÄÜ·¢ÉśČ”“ś·“Ó¦£¬¹ŹÕżČ·£»
c£®±ūĻ©ĖįÖŠĢ¼Ģ¼Ė«¼üÄÜ·¢Éś¼Ó¾Ū·“Ó¦£¬¹ŹÕżČ·£»
d£®±ūĻ©ĖįÖŠōČ»łÄÜ·¢ÉśÖŠŗĶ·“Ó¦£¬¹ŹÕżČ·£»
e£®±ūĻ©ĖįÖŠĢ¼Ģ¼Ė«¼üÄÜ·¢ÉśŃõ»Æ·“Ó¦£¬¹ŹÕżČ·£»
¹ŹŃ”a b c d e£»
£Ø3£©BŹĒŅŅ“¼”¢CŹĒŅŅĖį£¬ŅŅ“¼Äܱ»ĖįŠŌøßĆĢĖį¼ŲČÜŅŗŃõ»Æ¶ųŹ¹ĖįŠŌøßĆĢĖį¼ŲČÜŅŗĶŹÉ«£¬µ«ŅŅĖį²»ÄÜŹ¹ĖįŠŌøßĆĢĖį¼ŲČÜŅŗĶŹÉ«£¬ŅŅĖįÄÜŗĶĢ¼ĖįĒāÄĘ·“Ӧɜ³É¶žŃõ»ÆĢ¼£¬µ«ŅŅ“¼²»ÄÜ£¬ĖłŅŌæÉŅŌÓĆĢ¼ĖįĒāÄĘČÜŅŗ”¢ĖįŠŌøßĆĢĖį¼ŲČÜŅŗ¼ų±š¶žÕߣ¬
¹Ź“š°øĪŖ£ŗNaHCO3ČÜŅŗ£»KMnO4ĖįŠŌČÜŅŗ£»
£Ø4£©±ūĻ©ĖįŗĶŅŅ“¼·“Ӧɜ³É±ūĻ©ĖįŅŅõ„£¬Ęä½į¹¹¼ņŹ½ĪŖCH2=CH-COOCH2CH3£¬
¹Ź“š°øĪŖ£ŗCH2=CH-COOCH2CH3£»
£Ø5£©¢ŁĪŖŅŅĻ©ŗĶĖ®µÄ¼Ó³É·“Ó¦£¬·“Ó¦·½³ĢŹ½ĪŖCH2=CH2+H2O$”ś_{¼ÓČČ”¢¼ÓŃ¹}^{“߻ƼĮ}$CH3CH2OH£¬ĪŖ¼Ó³É·“Ó¦£»
¢ÜĪŖ±ūĻ©ĖįŗĶŅŅ“¼µÄõ„»Æ·“Ó¦£¬·“Ó¦·½³ĢŹ½ĪŖCH2=CHCOOH+HOCH2CH3$”ś_{”÷}^{ÅØĮņĖį}$CH2=CHCOOCH2CH3+H2O£¬ĪŖõ„»Æ·“Ó¦»ņČ”“ś·“Ó¦£¬
¢ŻĪŖ±ūĻ©Ėį·¢ÉśµÄ¼Ó¾Ū·“Ó¦£¬·“Ó¦·½³ĢŹ½ĪŖn CH2=CH-COOH$\stackrel{Ņ»¶ØĢõ¼žĻĀ}{”ś}$
¹Ź“š°øĪŖ£ŗ¢ŁCH2=CH2+H2O$”ś_{¼ÓČČ”¢¼ÓŃ¹}^{“߻ƼĮ}$CH3CH2OH£» ¼Ó³É£»
¢ÜCH2=CHCOOH+HOCH2CH3$”ś_{”÷}^{ÅØĮņĖį}$CH2=CHCOOCH2CH3+H2O£»õ„»Æ/Č”“ś
¢Żn CH2=CH-COOH$\stackrel{Ņ»¶ØĢõ¼žĻĀ}{”ś}$
µćĘĄ ±¾Ģāæ¼²éÓŠ»śĪļĶʶĻ£¬ĪŖøßĘµæ¼µć£¬²ąÖŲæ¼²éѧɜ·ÖĪöĶʶĻÄÜĮ¦£¬Ć÷Č·¹ŁÄÜĶż°ĘäŠŌÖŹ¹ŲĻµ¼°ĪļÖŹÖ®¼äµÄ×Ŗ»Æ”¢·“Ó¦Ģõ¼ž”¢·“Ó¦ĄąŠĶŹĒ½ā±¾Ģā¹Ų¼ü£¬×¢Ņā·“Ó¦ÖŠ¶Ļ¼üŗĶ³É¼ü·½Ź½£¬ĢāÄæÄŃ¶Č²»“ó£®


 ĘŚÄ©ø“Ļ°¼ģ²āĻµĮŠ“š°ø
ĘŚÄ©ø“Ļ°¼ģ²āĻµĮŠ“š°ø ³¬ÄÜѧµäµ„ŌŖĘŚÖŠĘŚÄ©×ØĢā³å“Ģ100·ÖĻµĮŠ“š°ø
³¬ÄÜѧµäµ„ŌŖĘŚÖŠĘŚÄ©×ØĢā³å“Ģ100·ÖĻµĮŠ“š°ø »ĘøŌ360¶Č¶ØÖĘĆܾķĻµĮŠ“š°ø
»ĘøŌ360¶Č¶ØÖĘĆܾķĻµĮŠ“š°ø Ńō¹āæ¼³”µ„ŌŖ²āŹŌ¾ķĻµĮŠ“š°ø
Ńō¹āæ¼³”µ„ŌŖ²āŹŌ¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Q1£¼Q2 | |
| B£® | Õż½»Įņ²»Čēµ„Š±ĮņĪČ¶Ø | |
| C£® | Õż½»Įņ¾ßÓŠµÄÄÜĮæ±Čµ„Š±ĮņµĶ | |
| D£® | µČÖŹĮæµÄµ„Š±ĮņŗĶÕż½»ĮņĶźČ«Č¼ÉÕÉś³ÉµÄ¶žŃõ»ÆĮņŅ»Ńł¶ą |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
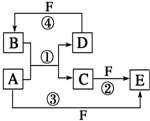 A”¢B”¢C”¢D”¢E”¢FĮłÖÖĪļÖŹµÄ×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾£Ø·“Ó¦Ģõ¼žŗĶ²æ·Ö²śĪļĪ“±ź³ö£©
A”¢B”¢C”¢D”¢E”¢FĮłÖÖĪļÖŹµÄ×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾£Ø·“Ó¦Ģõ¼žŗĶ²æ·Ö²śĪļĪ“±ź³ö£©²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŌŚ³£ĪĀ³£Ń¹ĻĀ£¬11.2 L N2ŗ¬ÓŠµÄ·Ö×ÓŹżĪŖ0.5 NA | |
| B£® | 2.4g Mg±äĪŖMg2+Ź±Ź§Č„µÄµē×ÓŹżÄæĪŖ0.2NA | |
| C£® | 1 L 1mol•L-1 CH3COONaČÜŅŗÖŠ“ęŌŚNAøöCH3COO- | |
| D£® | 1 mol Cn H2n+2ŗ¬ÓŠ£Ø3n+2£©NAøö¹²¼Ū¼ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĶʶĻĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
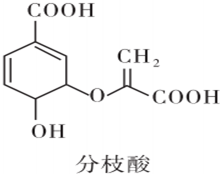
| A£® | Ęä·Ö×ÓŹ½ĪŖC10H8O6 | |
| B£® | æÉÓėŅŅ“¼”¢ŅŅĖį·“Ó¦£¬ĒŅ·“Ó¦ĄąŠĶĻąĶ¬ | |
| C£® | 1 mol·ÖÖ¦ĖįŌŚŅ»¶ØĢõ¼žĻĀ×ī¶ąæÉÓė3 mol NaOH·¢Éś·“Ó¦ | |
| D£® | æÉŹ¹äåµÄĖÄĀČ»ÆĢ¼ČÜŅŗ”¢ĖįŠŌøßĆĢĖį¼ŲČÜŅŗĶŹÉ«£¬ĒŅŌĄķĻąĶ¬ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŹÆÓ¢ | B£® | Ė®¾§ | C£® | ½šøÕÉ° | D£® | Āźč§ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | KNO3 CH3COOH | B£® | HCl NaHSO4 | C£® | NaCl BaSO4 | D£® | NH3•H2O H2SO4 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 2H2£Øg£©+O2£Øg£©ØT2H2O£Øg£©”÷H1£»2H2£Øg£©+O2£Øg£©ØT2H2O£Øl£©”÷H2 | |
| B£® | S£Øg£©+O2£Øg£©ØTSO2£Øg£©”÷H1£»S£Øs£©+O2£Øg£©ØTSO2£Øg£©”÷H2 | |
| C£® | 2SO2£Øg£©+O2£Øg£©ØT2SO3£Øg£©”÷H1£»2SO3£Øg£©ØTO2£Øg£©+2SO2£Øg£©”÷H2 | |
| D£® | ŅŃÖŖ·“Ó¦£ŗC£Ø½šøÕŹÆ£¬s£©ØTC£ØŹÆÄ«£¬s£©”÷H£¼0£¬C£Ø½šøÕŹÆ£¬s£©+O2£Øg£©ØTCO2£Øg£©”÷H1£»C£ØŹÆÄ«£¬s£©+O2£Øg£©ØTCO2£Øg£©”÷H2 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com