
| A. | 氮化硅陶瓷--导热剂 | B. | Si和Ge--半导体材料 | ||
| C. | 钢化玻璃--汽车窗玻璃 | D. | SiO2--制光纤 |
分析 A.氮化硅陶瓷具有耐高温、耐磨、抗高压、耐腐蚀等性能;
B.Si和Ge均具有金属性和非金属性;
C.钢化玻璃的硬度较大,破碎后不会形成尖角;
D.二氧化硅具有良好的光学特性.
解答 解:A.氮化硅陶瓷具有耐高温、耐磨、抗高压、耐腐蚀等性能,不能制导热剂,故A错误;
B.Si和Ge均具有金属性和非金属性,则均可作半导体材料,故B正确;
C.钢化玻璃的硬度较大,破碎后不会形成尖角,所以可用于汽车窗玻璃,故C正确;
D.二氧化硅具有良好的光学特性,是光导纤维主要成分,故D正确;
故选:A.
点评 本题考查物质的性质与用途,性质决定用途,熟悉相关物质的性质是解题关键,注意二氧化硅及含硅材料在生活、生产中的重要应用,题目难度不大.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 液态水的密度大于冰的密度 | B. | 碘单质和干冰容易升华 | ||
| C. | 氧气的氧化性不如氯气的氧化性 | D. | 溴容易溶于四氯化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D、E五种元素.其相关信息如下:
有A、B、C、D、E五种元素.其相关信息如下:| 元素 | 相关信息 |
| A | A元素的一种原子没有中子,只有一个质子 |
| B | B是电负性最大的元素 |
| C | C的基态原子2p轨道有三个未成对电子 |
| D | D为主族元素,且与E同周期,其最外层上有两个运动状态不同的电子 |
| E | E能形成砖红色(红色)的E2O和EO两种氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①⑤⑦⑧ | C. | ①⑤⑥ | D. | ⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的L层电子是K层电子数的3倍,下列说法不正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的L层电子是K层电子数的3倍,下列说法不正确的是( )| A. | Y的气态氢化物比X的稳定 | |
| B. | W的最高价氧化物对应水化物的酸性比Z的强 | |
| C. | Y的非金属性比Z的强 | |
| D. | X与Y形成的化合物都易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
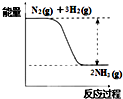 在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系.
在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
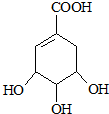
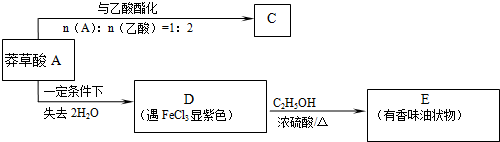
 .
.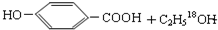 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$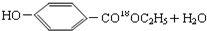 ②E与足量的NaOH溶液反应
②E与足量的NaOH溶液反应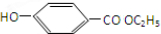 +2NaOH→
+2NaOH→ +H2O.
+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com