
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是( )
| A.若X+和Y2-的核外电子层结构相同,则原子序数:X>Y |
| B.由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S |
| C.在元素周期表中,硅、锗都位于金属与非金属的交界处,都可以作半导体材料 |
| D.Cs和Ba分别位于第六周期ⅠA族和ⅡA族,碱性:CsOH>Ba(OH)2 |
 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:单选题
根据中学化学教材所附元素周期表判断,下列叙述不正确的是( )
| A.K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等 |
| B.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等 |
| C.L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等 |
| D.M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
依据元素周期表及元素周期律,下列推断正确的是
| A.H3BO3的酸性比H2CO3的强 |
| B.Mg(OH)2的碱性比Be(OH)2的强 |
| C.HCl、HBr、HI的热稳定性依次增强 |
| D.若M+和R2-的核外电子层结构相同,则原子序数:R>M |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各项内容中,排列顺序正确的是( )
①固体的热稳定性:Na2CO3>CaCO3>NaHCO3 ②物质的熔点Li>Na>K
③微粒半径:K+>S2->F- ④单质的密度Na<K<Rb ⑤氢化物的沸点:H2Se>H2S>H2O
| A.①③ | B.②④ | C.①② | D.③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知33As、35Br位于同一周期,下列关系正确的是
| A.原子半径:As>C1>P | B.热稳定性:HC1>AsH3>HBr |
| C.还原性:As3->S2->C1- | D.酸性:H3AsO4>H2SO4>H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
五种短周期元素X、Y、Z、M、N的原子序数依次增大,X、Y、Z、M是组成蛋白质的基础元素,M原子的最外层电子数是电子层数的3倍,N2M2可用于潜水艇中作为氧气的来源,下列说法错误的是
| A.与Y同主族的短周期元素可与强碱反应生成氢气 |
| B.X和M形成的化合物分子中可能含有非极性共价键 |
| C.由X、Z、M形成的化合物一定是共价化合物 |
| D.等物质的量的N2YM3粉末和NXYM3粉末分别与等浓度的盐酸反应,后者反应速率要快 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知短周期元素甲、乙、丙、丁、戊的原子序数依次增大,它们的部分化合价如下表。下列说法正确的是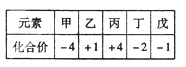
| A.乙的单质中能与水剧烈反应 |
| B.气态氢化物的稳定性:丙>甲 |
| C.丙的氧化物能与戊的氢化物水溶液反应 |
| D.其最高价氧化物对应的水化物的酸性:丁>戊 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
依据元素周期表及元素周期律,下列推断正确的是
| A.HCl、HBr、HI的热稳定性依次增强 |
| B.若M+和R2-的核外电子层结构相同,则原子序数:R>M |
| C.同主族元素从上到下,单质的熔点逐渐降低 |
| D.同周期元素(除0族元素外)从左到右,原子半径逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
月球上的每百吨He聚变所释放出的能量相当于目前人类一年消耗的能量,地球上氦元素主要以He的形式存在。已知一个12C原子的质量为a g,一个He原子的质量为b g,NA为阿伏加德罗常数。下列说法正确的是
| A.He比H多一个中子 | B.氦元素的近似相对原子质量为3 |
| C.He的相对原子质量为12b/a | D.He的摩尔质量为bNA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com