
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铜绿的主要成分是碱式碳酸铜 | 可用稀盐酸除铜器表面的铜绿 | Ⅰ对;Ⅱ对;有 |
| B | 铜表面易形成致密的氧化膜 | 铜容器可以盛放浓硫酸 | Ⅰ对;Ⅱ对;有 |
| C | 铁比铜活泼 | 铆在铜板上的铁钉在潮湿空气中不易生锈 | Ⅰ对;Ⅱ对;有 |
| D | 硫酸铜晶体受热转化为硫酸铜粉末属于风化过程 | 硫酸铜溶液可用作游泳池水的消毒 | Ⅰ错;Ⅱ对;无 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.铜绿的主要成分是碱式碳酸铜,稀盐酸和碱式碳酸铜发生复分解反应,Cu和稀盐酸不反应;
B.铜表面不能形成致密的氧化物薄膜,一定温度下铜和浓硫酸发生氧化还原反应,常温下不反应;
C.铁比铜活泼,铆在铜板上的铁钉在潮湿空气中发生电化学腐蚀,铁为负极,更易生锈;
D.风化是结晶水化物在室温和干燥空气里失去结晶水的现象,蓝色硫酸铜晶体受热转化为白色硫酸铜粉末不属于风化,硫酸铜作消毒剂是利用重金属盐的性质.
解答 解:A.陈述Ⅰ铜绿的主成分是碱式碳酸铜,正确;碱式碳酸铜是弱酸盐能和强酸反应,陈述Ⅱ碱式碳酸铜能和强酸反应生成盐和水、二氧化碳,正确;所以二者有因果关系,故A正确;
B.因铜是不活泼金属,所以陈述Ⅰ其表面不易形成致密的氧化膜,故错误;陈述Ⅱ常温下,铜和浓硫酸不反应,所以铜容器可以盛放浓硫酸,故正确;二者没有、因果关系,所以B错误;
C.因铁的金属性比铜的金属性强,所以陈述Ⅰ铁比铜活泼,故正确;陈述Ⅱ在铜板上的铁钉在潮湿空气中易形成原电池,铁为原电池的负极,所以更易生锈,故错误;二者有因果关系,所以C错误;
D.蓝色硫酸铜晶体受热转化为白色硫酸铜粉末时不是在在室温和干燥空气里失去结晶水的现象,所以不属于风化,所以陈述Ⅰ错误,重金属盐能使蛋白质变性,所以硫酸铜作消毒剂是利用重金属盐的性质,I、II没有因果关系,故D正确;
故选AD.
点评 本题考查铜金属及其化合物的性质,明确物质性质与用途的关系即可解答,注意常温下铜和浓硫酸不反应不是钝化现象,为易错点,题目难度不大.


 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳有氧化性,在点燃条件下能将金属镁氧化 | |
| B. | 二氧化硫有漂白、杀菌性能,可在食品加工中大量使用 | |
| C. | 二氧化氯具有还原性,可用于自来水的杀菌消毒 | |
| D. | 二氧化锰具有较强的氧化性,可作H2O2分解的氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用品: 有效成分:NaCl用途:做调味品 有效成分:NaCl用途:做调味品 | |
| B. | 用品: 有效成分:Na2CO3用途:做发酵粉 有效成分:Na2CO3用途:做发酵粉 | |
| C. | 用品: 有效成分:Al(OH)3用途:做抗酸药 有效成分:Al(OH)3用途:做抗酸药 | |
| D. | 用品: 有效成分:Ca(ClO)2用途:做消毒剂 有效成分:Ca(ClO)2用途:做消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 55 kJ | B. | 220 kJ | C. | 1108 kJ | D. | 550 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol.L-1硫酸钠溶液中含有溶质离子总数为1.5NA | |
| B. | 标准状况下,22.4L甲醇完全燃烧产生NA个CO2分子 | |
| C. | 常温常压下,46g NO2、N2O4混合物中,分子数为NA | |
| D. | 常温常压下,N2和O2混合气体22.4L所含的分子数少于6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| B. | 分子式为C4H7ClO2,可与NaHCO3产生CO2的有机物可能结构有3种 | |
| C. | 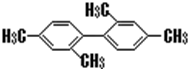 分子中至少有11个碳原子处于同一平面上 分子中至少有11个碳原子处于同一平面上 | |
| D. | 1mol有机物 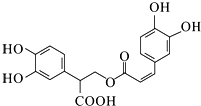 一定条件下能和7molNaOH反应 一定条件下能和7molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向0.1molFeI2溶液中滴加少量氯水,反应中有0.3mol电子转移 | |
| B. | 向溴水中加入足量氯化亚铁能使溶液变成无色 | |
| C. | 向NaClO溶液中通入少量CO2的离子方程式:ClO-+CO2+H2O═HClO+HCO3- | |
| D. | 能使pH试纸显深红色的溶液,Fe3+、Cl-、Ba2+、Br-能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铁与三氯化铁溶液反应:Fe+2Fe3+=3Fe2+ | |
| B. | 氯化铝溶液中加入过量的氨水Al3++4NH3•H2O=4NH4++AlO2-+2H2O | |
| C. | Fe(OH)3跟盐酸反应:Fe(OH)3+3H+=Fe3++3H2O | |
| D. | 钠和冷水反应:Na+2H2O=Na++H2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠可用于治疗胃酸过多,作胃酸中和剂 | |
| B. | 氧化钠和过氧化钠都能与二氧化碳反应,生成物完全相同 | |
| C. | 碳酸钠固体中混有少量碳酸氢钠,可用加热的方法除去 | |
| D. | 质量相等的碳酸钠和碳酸氢钠分别与足量盐酸反应,后者产生气体少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com