
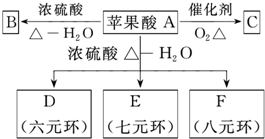
 苹果醋(ACV)是一种由苹果发酵而成的酸性饮品,具有解毒、降脂等药效,主要酸性物质为苹果酸.该苹果酸在分离提纯后的化学分析如下:
苹果醋(ACV)是一种由苹果发酵而成的酸性饮品,具有解毒、降脂等药效,主要酸性物质为苹果酸.该苹果酸在分离提纯后的化学分析如下:| 5×16 |
| 0.597 |
| 134×35.82% |
| 12 |
| 134×4.48% |
| 1 |
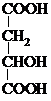 ,结合转化关系可知,B中含双键,B为HOOC-CH=CH-COOH,A→C发生催化氧化,则C为
,结合转化关系可知,B中含双键,B为HOOC-CH=CH-COOH,A→C发生催化氧化,则C为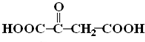 ,A生成D、E、F均为取代反应,A中含有-OH和-COOH,两分子A可发生酯化反应生成环酯,以此解答该题.
,A生成D、E、F均为取代反应,A中含有-OH和-COOH,两分子A可发生酯化反应生成环酯,以此解答该题.| 5×16 |
| 0.597 |
| 134×35.82% |
| 12 |
| 134×4.48% |
| 1 |
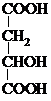 ,结合转化关系可知,B中含双键,B为HOOC-CH=CH-COOH,A→C发生催化氧化,则C为
,结合转化关系可知,B中含双键,B为HOOC-CH=CH-COOH,A→C发生催化氧化,则C为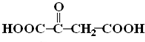 ,A生成D、E、F均为取代反应,A中含有-OH和-COOH,两分子A可发生酯化反应生成环酯,
,A生成D、E、F均为取代反应,A中含有-OH和-COOH,两分子A可发生酯化反应生成环酯,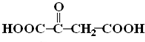 ,故答案为:HOOCCH=CHCOOH;
,故答案为:HOOCCH=CHCOOH;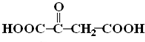 ;
;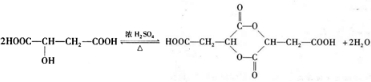 ,
, ;
;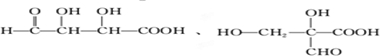 ,故答案为:
,故答案为: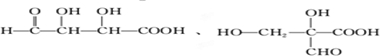 .
.


科目:高中化学 来源: 题型:
| A、甲酸蒸气的密度在373K时为1.335g?L-1,在293K时为2.5g?L-1 |
| B、氨分子与水分子形成一水合氨 |
| C、水结冰体积增大 |
| D、SbH3的沸点比PH3高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
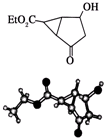
| A、该有机物的核磁共振氢谱有6个吸收峰 |
| B、该有机物属于芳香化合物 |
| C、键线式中的Et代表的基团为-CH3 |
| D、该有机物在一定条件下能够发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、① | B、①② | C、①②⑤ | D、②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
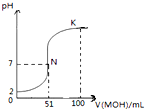 (1)常温下,将三种一元酸分别和NaOH溶液等体积混合,实验数据如下:
(1)常温下,将三种一元酸分别和NaOH溶液等体积混合,实验数据如下:| 组别 | 一元酸 | NaOH | 混合溶液的pH |
| 甲 | c(HX)=0.1mol/L | c(NaOH)=0.1mol/L | pH=a |
| 乙 | c(HY)=c1 mol/L | c(NaOH)=0.1mol/L | pH=7 |
| 丙 | c(HZ)=0.1mol/L | c(NaOH)=0.1mol/L | pH=9 |
| 丁 | pH=2 HZ | pH=12 NaOH | pH=b |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com