
| A. | 100ρV/(36.5V+2240) | B. | 1000ρV/(36.5V+2240) | ||
| C. | ρ V/(36.5V+2240) | D. | (1000+36.5ρV)/( 36.5V+2240) |
分析 HCl的物质的量为n=$\frac{V}{{V}_{m}}$,根据V=$\frac{m}{ρ}$可计算溶液的体积,根据c=$\frac{n}{V}$和c=$\frac{1000ρ?}{M}$可计算溶液的物质的量浓度.
解答 解:根据c=$\frac{1000ρ?}{M}$可知,HCl的浓度是c=$\frac{1000ωρ}{36.5}$mol/L;
氯化氢的物质的量是$\frac{V}{22.4}$mol,质量是$\frac{V}{22.4}$×36.5g,溶剂的质量是100g.所以溶液的体积是V=$\frac{m}{ρ}$=$\frac{\frac{36.5V}{22.4}+100}{ρ}$,
所以溶液的浓度是$\frac{1000νρ}{36.5V+2240}$mol/L,故B正确;
故选B.
点评 本题考查物质的量浓度的计算,题目难度中等,解答本题的关键是能把握相关计算公式的运用,易错点为相关单位的换算,侧重于考查学生的分析能力和计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
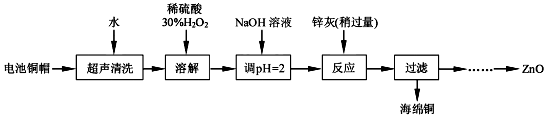
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 完全沉淀的pH | 3.2 | 8.8 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=4 | |
| B. | 平衡时气体压强是原来压强的1.1倍 | |
| C. | A的平衡浓度是1.4 mol•L-1 | |
| D. | B的转化率是40% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直径介于1nm~100nm之间的微粒称为胶体 | |
| B. | 电泳现象可以证明胶体粒子带电 | |
| C. | 丁达尔效应是溶液与胶体的本质区别 | |
| D. | 胶体粒子很小,可以透过滤纸和半透膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{ρV}{MV+2240}$mol/L | B. | $\frac{1000ρV}{MV+2240}$mol/L | ||
| C. | $\frac{MV}{22.4V+0.1ρ}$mol/L | D. | $\frac{V}{2.24}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用A表示反应的速率为0.1 mol•L-1•s-1 | |
| B. | 用B表示反应速率为0.4 mol•L-1•s-1 | |
| C. | 3s时生成C的物质的量为1.2mol | |
| D. | 3s时B的浓度为0.6mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,8g O2中电子数为4NA | |
| B. | 3.4gNH3中含原子总数为0.6 NA | |
| C. | 分子数为NA的CO、C2H4混合气体体积约为22.4L,质量约为28g | |
| D. | 标况下,33.6 L的四氯化碳中,四氯化碳分子数为1.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com