
分析 (1)反应方程式为:N2H4+2H2O2=N2+4H2O,根据0.4mol液态肼放出的热量,计算1mol液态肼放出的热量,进而写出热化学方程式;
(2)根据盖斯定律合并写出生成液态水时的热化学方程式进行计算;
(3)依据反应N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)的产物是氮气和水分析该反应的优点;
(4)①N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol
②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol
依据盖斯定律计算②×2-①得到:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l).
解答 解:(1)反应方程式为:N2H4+2H2O2═N2+4H2O,0.4mol液态肼放出256.652KJ的热量,则1mol液态肼放出的热量为$\frac{265.652KJ}{0.4}$=641.63kJ,
所以反应的热化学方程式为:N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63kJ/mol,
故答案为:N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.63kJ/mol;
(2)①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63kJ/mol;
②H2O(g)=H2O(l)△H=-44kJ/mol;
依据盖斯定律①+②×4得到:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l);△H=-817.63kJ/mol;
热化学方程式中32g全部反应放热817.63kJ,16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量为:817.63kJ×$\frac{1}{2}$=408.815kJ,
故答案为:408.815;
(3)还原剂肼(N2H4)和强氧化剂H2O2,当它们混合时,即产生大量的氮气和水蒸气,除释放大量热量和快速产生大量气体外,还有很突出的优点是,产物为氮气和水,清洁无污染,
故答案为:产物无污染;
(4)①N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol
②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol
依据盖斯定律计算②×2-①得到:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l),△H=-1135.7 kJ/mol;
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)△H=-1135.7 kJ/mol.
点评 本题考查了热化学方程式的书写、有关反应热的计算,题目难度中等,注意盖斯定律的应用,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “地沟油”禁止食用,但可以用来制肥皂 | |
| B. | 金属的硬度都比较大,不能用刀切 | |
| C. | “玉兔”月球车太阳能电池帆板的材料是二氧化硅 | |
| D. | 煤经过气化和液化等物理变化可转化为清洁燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
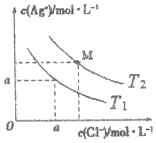 已知AgCl在水中的溶解是吸热过程.不同温度下,AgCl在水中的沉淀溶解平衡曲线如图所示.己知T1温度下Ksp(AgCl)=1.6×10-9,下列说法正确的是( )
已知AgCl在水中的溶解是吸热过程.不同温度下,AgCl在水中的沉淀溶解平衡曲线如图所示.己知T1温度下Ksp(AgCl)=1.6×10-9,下列说法正确的是( )| A. | T1>T2 | |
| B. | a=4.0×10-5 | |
| C. | M点溶液温度变为T1时,溶液中Cl-的浓度不变 | |
| D. | T2时饱和AgCl溶液中,c(Ag+)、c(Cl-)可能分别为2.0×10-5mol/L、4.0×10-5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | CO2 晶胞如图1所示,一个CO2 分子周围有12个CO2 分子紧邻 | |
| B. | 由E原子和F原子构成的气态团簇分子模型如图2所示,其分子式为EF或FE | |
| C. | H原子的电子云图如图3所示,H原子核外的大多数电子在原子核附近运动 | |
| D. | 金属Cu原子堆积模型如图4所示,该金属晶体为六方最密堆积,Cu原子的配位数为12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲乙丙丁戊是中学常见的无机物,他们的转化关系如图所示(某些条件和部分产物已略去).下列说法错误的是( )
甲乙丙丁戊是中学常见的无机物,他们的转化关系如图所示(某些条件和部分产物已略去).下列说法错误的是( )| A. | 若戊为一种强碱且焰色反应为黄色,则反应①②可能都属于氧化还原反应 | |
| B. | 常温下,若丙为无色气体,戊为红棕色气体,则甲、乙是铜和稀硝酸 | |
| C. | 若甲为硫磺燃烧产物,丁为水,则戊可用于干燥甲 | |
| D. | 若甲为浓盐酸,乙为MnO2,则戊可能使品红褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 实验I:逐滴滴加盐酸时,试管中立即产生大量气泡. | |
| B. | 实验II:充分振荡后静置,下层溶液为橙红色,上层无色 | |
| C. | 实验III:从饱和食盐水中提取NaCl晶体 | |
| D. | 装置IV:逐滴加入NaOH溶液时,可以看到白色沉淀,转而变成灰绿色,最后是红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若B、D是空气的主要成分,则A可能用做制冷剂 | |
| B. | 若A、B、C的水溶液均显碱性,焰色反应均为黄色,则C可能用做胃酸中和剂 | |
| C. | 若D为生产生活中用量最大、用途最广泛的金属单质,则B可能为Fe( NO3)2 | |
| D. | 若B具有两性,则D可能为NaOH溶液或盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某模拟“人工树叶”的电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法错误的是( )
某模拟“人工树叶”的电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法错误的是( )| A. | 该装置工作时,H+从b极区向a极区迁移 | |
| B. | 每生成1molO2,有44gCO2被还原 | |
| C. | a电极的反应式为3CO2+18H++18e-═C3H8O+5H2O | |
| D. | C3H8O和O2形成燃料电池以氢氧化钠作为电解质溶液的负极反应式:C3H8O-18e-+24OH-═3CO32-+16H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com