
分析 该烃的相对分子质量=46×2=92,则$\frac{92}{12}$=7…8,由于6个C原子最多结合14个H原子,则分子式为C7H8,9.2g该烃为0.1mol,与0.3molH2发生加成反应生成相应的饱和烃CmHp,由于该烃不能使溴水褪色,可使高锰酸钾酸性溶液褪色,所以它应当是苯的同系物,故为甲苯,甲苯与浓硝酸在浓硫酸作用下生成三硝基甲苯.
解答 解:(1)该烃的相对分子质量=46×2=92,则$\frac{92}{12}$=7…8,由于6个C原子最多结合14个H原子,则分子式为C7H8,
答:有机物分子式为C7H8.
(2)9.2g该烃为0.1mol,与0.3molH2发生加成反应生成相应的饱和烃CmHp,由于该烃不能使溴水褪色,可使高锰酸钾酸性溶液褪色,所以它应当是苯的同系物,故该烃为甲苯,与氢气发生加成反应生成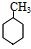
,
答:CmHp的结构简式为: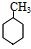 .
.
(3)甲苯与浓硝酸在浓硫酸作用下生成三硝基甲苯,反应方程式为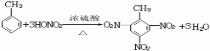 ,
,
答:该反应的化学方程式 .
.
点评 本题考查有机物的推断,题目难度不大,注意利用相对分子质量商余法确定烃的分子式,熟练掌握官能团的性质与转化.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题

| A. | a、b、c的简单离子中,b的离子半径最大 | |
| B. | c、d、f最高价氧化物对应的水化物两两之间均可发生反应 | |
| C. | e的氢化物比f的氢化物的稳定性高 | |
| D. | 离子半径a3-小于d3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,22.4LH2的分子数为1NA | |
| B. | 0 5mol•L-1的MgCl2溶液,含有Cl数为1NA | |
| C. | 56g铁片投人足量的浓硫酸中生成1.5NA个SO2分子 | |
| D. | 常温常压下,14gN2含有分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 预期现象和结论 | |
| ① | 取样品于试管中,加入适量2.0mol•L-1盐酸溶解后,再将产生的气体经蒸馏水、四氯化碳后导入澄清石灰水中 | a.若澄清石灰水未见浑浊,则假设1成立 b.若澄清石灰水变浑浊,则假设2或3成立 |
| ② | 取样品于试管中,加入适量2.0mol•L-1盐酸溶解后,再向试管中滴入1-2滴品红溶液,振荡 | 若品红褪色,结合实验①中的现象和结论b,则假设3 成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两个原子或多个原子之间的相互作用叫做共价键 | |
| B. | 阴、阳离子间通过静电引力而形成的化学键叫做离子键 | |
| C. | 分子晶体中一定含有共价键,离子晶体中一定含有离子键 | |
| D. | 氯化钠晶体中含有阳离子,氯化钠溶液中也含有阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com