
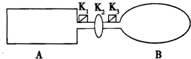
 如图装置中,A是由导热材料制成的密闭容器,B是耐化学腐蚀且易于传热的透明气球,关闭K2,将等量的1molNO2通过K1、K3分别充A、B中,反应起始时,A、B的体积相同均为a L.已知:2NO2(g)?N2O4(g)△H<0
如图装置中,A是由导热材料制成的密闭容器,B是耐化学腐蚀且易于传热的透明气球,关闭K2,将等量的1molNO2通过K1、K3分别充A、B中,反应起始时,A、B的体积相同均为a L.已知:2NO2(g)?N2O4(g)△H<0分析 (1)平衡时二氧化氮浓度不变,颜色不变化;
(2)若平衡后向A中再充入0.5molN2O4,等效为在原平衡基础上增大压强,平衡正向移动;
(3)压强之比等于物质的量之比,计算平衡时混合气体物质的量,根据方程式计算反应的NO2的物质的量,再根据v=$\frac{△c}{△t}$计算v(NO2);
(4)打开开关K,保持温度不变,再达平衡时,等效为开始加入2molNO2到达的平衡,恒温恒压下与B中平衡为等效平衡,反应物转化率不变,平衡时混合气体总物质的量为B中2倍,恒温恒压下压强之比等于物质的量之比,则开始加入2molNO2到达的平衡时总体积为原平衡中气球B体积的2倍.
解答 解:(1)平衡时二氧化氮浓度不变,颜色不变化,B中可以根据气体颜色不变说明到达平衡,故答案为:气体颜色不变;
(2)若平衡后向A中再充入0.5molN2O4,等效为在原平衡基础上增大压强,平衡正向移动,重新到达平衡后,平衡混合气中NO2的体积分数减小,
故答案为:减小;
(3)压强之比等于物质的量之比,平衡时混合气体物质的量为1mol×0.8=0.8mol,则:
2NO2(g)?N2O4(g)
起始量(mol):1 0
转化量(mol):x 0.5x
平衡量(mol):1-x 0.5x
所以1-x+0.5x=0.8,解得x=0.4,
则v(NO2)=$\frac{\frac{0.4mol}{aL}}{ts}$=$\frac{0.4}{at}$mol/(L.min),
故答案为:$\frac{0.4}{at}$mol/(L.min);
(4)打开开关K,保持温度不变,再达平衡时,等效为开始加入2molNO2到达的平衡,恒温恒压下与B中平衡为等效平衡,反应物转化率不变,平衡时混合气体总物质的量为B中2倍,恒温恒压下压强之比等于物质的量之比,则开始加入2molNO2到达的平衡时总体积为原平衡中气球B体积的2倍,所以打开K2之前,气球B体积为(aL+0.4aL)÷2=0.7aL,
故答案为:0.7a.
点评 本题考查化学平衡计算,涉及等效平衡问题,较好的考查学生分析解决问题能力,关键是等效平衡途径的建立,难度中等.


科目:高中化学 来源: 题型:解答题
 反应类型加聚反应(或聚合反应);
反应类型加聚反应(或聚合反应); 反应类型取代反应
反应类型取代反应 _反应类型加聚反应
_反应类型加聚反应查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3 | B. | AgNO3 | C. | NaHCO3 | D. | 酚酞 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图是制取无水氯化铜的实验装置图,将分液漏斗中的浓硫酸滴加到盛有固体食盐和二氧化锰混合物的烧瓶中,请回答下列问题:
如图是制取无水氯化铜的实验装置图,将分液漏斗中的浓硫酸滴加到盛有固体食盐和二氧化锰混合物的烧瓶中,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒温下压缩体积,容器中气体的平均相对分子质量减少 | |
| B. | 再加入一定量氨基甲酸铵,平衡正向移动 | |
| C. | CO2的体积分数不变则该反应达到平衡状态 | |
| D. | 25℃时氨基甲酸铵的分解平衡常数为2.048×10-9mol3•L-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种物质所含分子数目从大到小的顺序是:②>③>④>① | |
| B. | 四种物质质量从大到小的顺序是:③>②>④>① | |
| C. | 四种气体在标准状况下的体积从大到小的顺序是:②>③>④>① | |
| D. | 四种物质所含原子数目从大到小的顺序是:②>③>④>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用蒸馏水替代a中饱和食盐水产生的乙炔更为纯净 | |
| B. | c(过量)的作用是除去影响后续实验的杂质 | |
| C. | d、e褪色原理相同 | |
| D. | f处产生明亮的蓝色火焰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15% | B. | 10.05% | C. | 9.5% | D. | 5% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com