
| Y | Z | ||
| X | W |
| A. | 原子半径:X<Y<Z | |
| B. | 气态氢化物的稳定性:X>Z | |
| C. | Z、W均可与Mg形成离子化合物 | |
| D. | 最高价氧化物对应水化物的酸性:Y>W |
分析 Y、W的原子序数之和是Z的3倍,设Y的原子序数为x,则Z的原子序数为x+1,W的原子序数为x+10,则x+x+10=3×(x+1),解得x=7,即Y为N,结合位置关系可知,Z为O,X为Si,W为Cl,然后结合元素化合物知识来解答.
解答 解:Y、W的原子序数之和是Z的3倍,设Y的原子序数为x,则Z的原子序数为x+1,W的原子序数为x+10,则x+x+10=3×(x+1),解得x=7,即Y为N,结合位置关系可知,Z为O,X为Si,W为Cl,
A.电子层越多,原子半径越大,则原子半径为X>Y>Z,故A错误;
B.非金属性越强,气态氢化物越稳定,则气态氢化物的稳定性为X<Z,故B错误;
C.Z、W均可与Mg形成离子化合物,分别为MgO、MgCl2,故C正确;
D.Cl的最高价氧化物对应水化物的酸性为含氧酸中酸性最强的酸,则最高价氧化物对应水化物的酸性:Y<W,故D错误;
故选C.
点评 本题为2015年山东高考题,侧重位置、结构与性质的考查,把握原子序数的关系推断元素为解答的关键,注意元素性质的比较方法,选项D为解答的易错点,题目难度不大.


 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:解答题
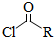 )偶联可用于制备药物Ⅱ:
)偶联可用于制备药物Ⅱ: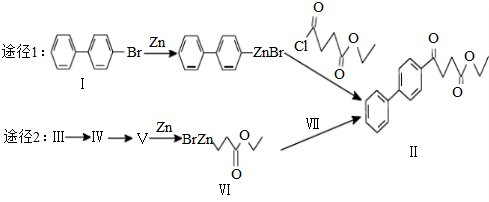
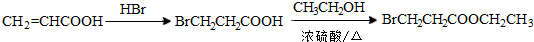 .(标明反应试剂,忽略反应条件).
.(标明反应试剂,忽略反应条件).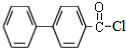 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $→_{△①}^{NaOH水溶液}$$\stackrel{A}{({C}_{5}{H}_{12}{O}_{2)}}$$→_{②}^{氧化}$$\underset{B}{({C}_{5}{H}_{8}{O}_{2})}$$→_{③}^{氧化}$C$→_{浓硫酸△④}^{试剂Ⅰ(C_{2}H_{5}OH)}$D
$→_{△①}^{NaOH水溶液}$$\stackrel{A}{({C}_{5}{H}_{12}{O}_{2)}}$$→_{②}^{氧化}$$\underset{B}{({C}_{5}{H}_{8}{O}_{2})}$$→_{③}^{氧化}$C$→_{浓硫酸△④}^{试剂Ⅰ(C_{2}H_{5}OH)}$D


 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$ +2NaBr.
+2NaBr.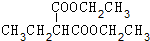 +(CH3)2CHCH2CH2Br+CH3CH2ONa→
+(CH3)2CHCH2CH2Br+CH3CH2ONa→ +CH3CH2OH+NaBr.
+CH3CH2OH+NaBr. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.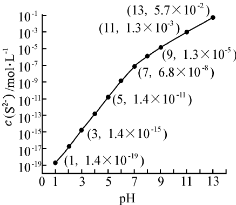
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
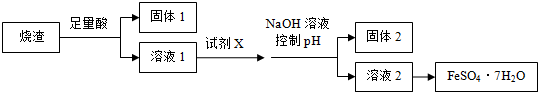
| A. | 溶解烧渣选用足量硫酸,试剂X选用铁粉 | |
| B. | 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2 | |
| C. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解 | |
| D. | 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4•7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合金贮氢材料具有优异的吸放氢性能,在配合氢能的开发中起到重要作用.
合金贮氢材料具有优异的吸放氢性能,在配合氢能的开发中起到重要作用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气通过灼热的氧化铜粉末 | B. | 二氧化碳通过过氧化钠粉末 | ||
| C. | 铝与氧化铁发生铝热反应 | D. | 将锌粒投入硝酸铜溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Cl2与NaOH溶液的反应中,每0.1molCl2参加反应时,转移电子的数目为0.2NA | |
| B. | 0.1mol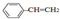 中含有双键的数目为0.4NA 中含有双键的数目为0.4NA | |
| C. | 标准状况下,11.2L乙醇中含有羟基的数目为0.5NA | |
| D. | 4.6g由NO2和N2O4组成的混合物中含有氧原子的数目为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com