
【题目】工业上用有机原料A制备 和聚乙酸乙烯酯,其流程为:
和聚乙酸乙烯酯,其流程为:

已知:①![]() ②
②![]()
请回答下列问题:
(1)A→B的反应类型是___________,J中官能团的名称为___________。
(2)反应②的试剂和条件分别是___________,G的结构简式是___________。
(3)写出反应①的化学方程式:_________________________________。
(4)与A具有相同官能团且只有一个甲基的芳香化合物的同分异构体有多种,写出其中一种核磁共振氢谱为五组峰且能发生银镜反应的结构简式为______________________。
(5)参照下述示例合成路线,设计一条由乙二醇为起始原料制备聚乙二酸乙二醋的合成路线。示例:![]() _______________
_______________
【答案】取代反应 羟基、羧基 O2 /Cu、加热 CH3COOCH===CH2 ![]()
![]()
【解析】
由聚乙酸乙烯酯的结构简式可知G为CH3COOCH=CH2,故C为CH3COONa,E为CH3COOH,F为CH3CHO,由于存在平衡:CH2=CHOH![]() CH3CHO,CH3COOH与CH2=CHOH发生酯化反应得到CH3COOCH=CH2.A在光照条件下发生取代反应生成B,B发生酯的水解反应、卤代烃水解反应得到C、D,则B中含有酯基,且D可以连续发生氧化反应,故D中含有-CH2OH,H含有-CHO,I酸化得到J,故J中含有-COOH,由产物
CH3CHO,CH3COOH与CH2=CHOH发生酯化反应得到CH3COOCH=CH2.A在光照条件下发生取代反应生成B,B发生酯的水解反应、卤代烃水解反应得到C、D,则B中含有酯基,且D可以连续发生氧化反应,故D中含有-CH2OH,H含有-CHO,I酸化得到J,故J中含有-COOH,由产物 可推知J为
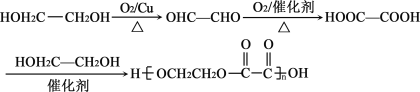
可推知J为![]() ,逆推可知,I为
,逆推可知,I为 ,H为
,H为![]() ,D为
,D为![]() ,B为
,B为![]() ,A为
,A为![]() ,J发生缩聚反应得到
,J发生缩聚反应得到![]()
(5)乙二醇发生催化氧化生成OHC-CHO,再进一步氧化生成HOOC-COOH,最后与乙二醇在浓硫酸、加热条件下发生酯化反应得到乙二酸乙二酯。
(1)A在光照条件下发生取代反应生成B,A→B的反应类型是取代反应,![]() 中官能团的名称为羟基、羧基。
中官能团的名称为羟基、羧基。
(2)D可以连续发生氧化反应,故D中含有-CH2OH,反应②的试剂和条件分别是O2 /Cu、加热,G的结构简式是CH3COOCH===CH2。
(3)B发生酯的水解反应、卤代烃水解反应得到C、D,反应①的化学方程式:![]() 。
。
(4)A为![]() ,A的同分异构体中,与A具有相同官能团且只有一个甲基的芳香化合物的同分异构体有多种,其中核磁共振氢谱为五组峰且能发生银镜反应,结构简式为
,A的同分异构体中,与A具有相同官能团且只有一个甲基的芳香化合物的同分异构体有多种,其中核磁共振氢谱为五组峰且能发生银镜反应,结构简式为![]() 。
。
(5)乙二醇发生催化氧化生成OHC-CHO,再进一步氧化生成HOOC-COOH,最后与乙二醇在浓硫酸、加热条件下发生酯化反应得到乙二酸乙二酯,合成路线流程图为:


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】重铬酸钠在制革工业、印刷工业、电镀工业等有重要用途,制备重铬酸钠(Na2Cr2O7)的方案1的流程图如图,铬铁矿的主要成分可表示为FeO·Cr2O3,还含有Al2O3、Fe2O3、SiO2等杂质。

除此外工厂还有相关改进工艺,制备重铬酸钠(Na2Cr2O7)的方案2如图,采用电化学原理如图所示的装置(电极为石墨),通过电解提高阳极区溶液的酸性,实现Na2CrO4转化为Na2Cr2O7。

(1)在方案2中请指明哪端是阴极? ___________(填“左”或“右”)。写出阳极的电极方程式:______________________。
(2)方案1中煅烧前应将铬铁矿充分粉碎,其目的是______________________。灼烧是中学化学中常用的操作方法,如在实验室中将铬铁矿和碳酸钠固体混合物灼烧,下列各实验仪器中不需要的是___________(填序号)。
a.陶瓷坩埚 b.铁坩埚 c.三脚架 d.泥三角
转窑中发生的主要反应除了下面的两个反应外,还有其他反应。
①Na2CO3+Al2O3![]() 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
②_____FeO·Cr2O3+______Na2CO3+______O2![]() ______Na2CrO4+______Fe2O3+______。
______Na2CrO4+______Fe2O3+______。
请配平反应②的化学方程式。
请写出其他主要反应方程式:_________________________________。
(3)固体Y的化学式为___________、___________。
(4)向母液中加入浓硫酸,把铬酸钠转化为重铬酸钠,经两次蒸发,主要是除去___________(填化学式),冷却至30-40℃得到产品晶体。洗涤该晶体的溶剂最好是___________(填序号)。
a.蒸馏水 b无水乙醇 c.75%乙醇溶液
(5)为了测定实验制得的产品中Na2Cr2O7,的含量,称取样品0.140g置于锥形瓶中,加50mL水;再加入2gKI(过量)及稍过量的稀硫酸溶液,摇匀,暗处放置10min;然后加入150mL蒸馏水并加入3mL0.5%淀粉溶液;用0.1000mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液30.00mL。(假定杂质不参加反应,已知:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,I2+2S2O32-===2I-+S2O62-)
①终点实验现象是_______________________________________________________。
②该产品中Na2Cr2O7的纯度为______________________。(以质量分数表示)
③若滴定管在滴定前俯视读数,滴定结束后仰视读数,测得样品的纯度将___________(填“偏高”或“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
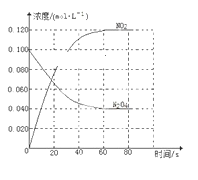
(1)反应的ΔH________(填“大于”或“小于”)0;100 ℃时,体系中各物质浓度随时间变化如下图所示。在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1。
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
a.T________(填“大于”或“小于”)100 ℃,判断理由是________________________________。
b.温度T时反应的平衡常数K2=____________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是常温下向20.0 mL的盐酸中,逐滴加入0.10 mol·L-1 NaOH溶液时,溶液的pH随 NaOH溶液的体积V(mL)变化的曲线,根据图像所得的下列结论中正确的是

A. 原盐酸的浓度为0.10 mol·L-1
B. x的值为2.0
C. 当pH=12时,V值为20.4
D. 原盐酸的浓度为1.0 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的转化系统原理示意图。下列说法正确的是

A. 好氧微生物反应器中反应为:NH4++2O2==NO3-+2H++H2O
B. B极电势比A极电势低
C. A极的电极反应式CH3COO-+8e-+2H2O==2CO2+7H+
D. 当电路中通过1mol电子时,理论上总共生成2.24LN2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.根据下表左边的“实验操作”,从右边的“实验现象”中选择正确的字母代号,填入对应“答案”的空格中。
实验操作 | 答案 | 实验现象 |
(1)让一束光线通过Fe(OH)3胶体 | ______ | A.呈蓝色 B.生成白色胶状沉淀 C.呈现光亮“通路” D.产生红褐色沉淀 |
(2)向盛有FeCl3溶液的试管中加入NaOH溶液 | ______ | |
(3)向Al2(SO4)3溶液中滴加氨水 | ______ | |
(4)向土豆片上滴加碘水 | ______ |
Ⅱ.某校化学兴趣小组,通过下列装置探究Na2CO3和NaHCO3的热稳定性,设计如下的探究方案,请你参与并完成该探究方案。
(1)提出假设:Na2CO3或NaHCO3加热分解时可能有CO2生成。
(2)设计实验:①利用下图装置分别对一定量的Na2CO3和NaHCO3进行加热;②为了检验CO2的生成,试管B中应加入的物质是_____________。
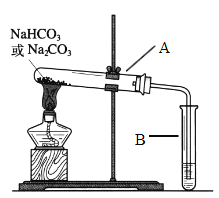
(3)现象与结论:同学们发现只有在加热NaHCO3时,试管B中才有气泡产生且有_______________沉淀生成(填沉淀的颜色),说明Na2CO3和NaHCO3的热稳定性是:Na2CO3_______ NaHCO3(填“>”或“<”)。
(4)某同学在探究NaHCO3的热稳定性时,称取了8.4gNaHCO3,充分加热,请你计算理论上可产生CO2气体的体积为__________L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如下图所示,图中含酚废水中有机物可用C6H6O表示,左、中、右室间分别以离子交换膜分隔。下列说法不正确的是( )

A. 左池的pH值降低
B. 右边为阴离子交换膜
C. 右池电极的反应式:2NO3-+10e-+12H+= N2↑+ 6H2O
D. 当消耗0.1molC6H6O,在标准状况下将产生0.28mol氮气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是( )
A.2mol水的摩尔质量和1mol水的摩尔质量
B.20%NaOH溶液中NaOH的物质的量浓度和10%NaOH溶液中NaOH的物质的量浓度
C.64g二氧化硫中氧原子数和标准状况下22.4L一氧化碳中氧原子数g
D.200mL1mol/L氯化钙溶液中c(Cl-)和200mL1mol/L氯化钾溶液中c(Cl-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com