
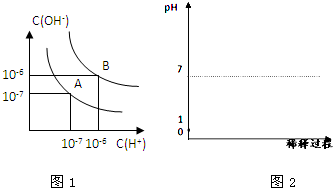
| c(CH3COO-)c(H+) |
| c(CH3COOH) |
| 1.75 |
| c(CH3COO-)c(H+) |
| c(CH3COOH) |
| c(CH3COO-)c(H+) |
| c(CH3COOH) |
| 1.75×10-5×0.1 |
 ,故答案为:
,故答案为: .
.


科目:高中化学 来源: 题型:
| A、一定条件下,l mol N2与足量H2反应生成NH3,转移电子6NA |
| B、标准状况下,11.2 L CCl4中含有C-Cl键的数目为2NA |
| C、1 mol甲基(-14C1H3)含有的中子数和电子数分别为8NA、9NA |
| D、1 mol?L-1Na2CO3溶液中含有的钠离子总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
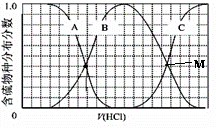 向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量.其中H2S、HS-、S2-的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出).试分析:
向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量.其中H2S、HS-、S2-的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出).试分析:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol任何气体的体积都是22.4L |
| B、1molH2的质量是2g?mol-1,它所占的体积是22.4L?mol-1 |
| C、标准状况下,1moL任何物质所占的体积都约为22.4L |
| D、标准状况下,1mol任何气体所占的体积都约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用铂丝蘸取某未知溶液于酒精灯火焰上灼烧,显黄色,证明该溶液中含Na+不含K+ |
| B、用湿润的淀粉碘化钾来检验氯气的存在 |
| C、某未知溶液中先加氯水,再滴加KSCN溶液出现血红色,证明溶液中含有Fe2+ |
| D、某无色溶液中加BaCl2溶液产生白色沉淀,证明原溶液中含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
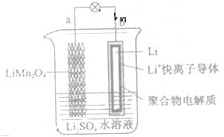 水锂电是当今锂电池研发的前沿和方向之一,理论上水锂电能量密度大,能量效率高达95%.关于如图所示的水溶液锂离子电池体系的叙述正确的是( )
水锂电是当今锂电池研发的前沿和方向之一,理论上水锂电能量密度大,能量效率高达95%.关于如图所示的水溶液锂离子电池体系的叙述正确的是( )| A、a为电池的负极 |
| B、放电时,a极锂的化合价发生变化 |
| C、放电时,溶液中Li+从b向a迁移 |
| D、电池充电反应为Li1-xMn2O4+xLi═LiMn2O4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com