
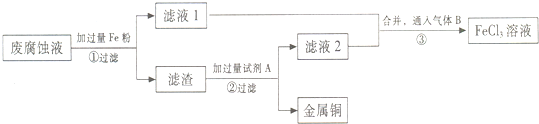
分析 由流程可知,废腐蚀液含有大量CuCl2、FeCl2、FeCl3,加过量Fe,CuCl2、FeCl3均与之反应,铁粉过量,则滤液1为FeCl2,滤渣中含Fe、Cu,加过量试剂A为盐酸,过滤得到金属Cu,滤液2中含FeCl2、HCl,为不引人杂质,将铁的化合物全部转化为FeCl3溶液,则气体B为氯气,以此来解答.
(1)印刷电路的废腐蚀液中的CuCl2、FeCl3与铁粉反应生成Fe2+、Cu;
(2)滤渣中含有Fe和Cu,除去其中的Fe选用盐酸;
(3)废腐蚀液加铁粉后,溶液为亚铁离子的溶液,通入氯气得到三氯化铁溶液.
解答 解:(1)印刷电路的废腐蚀液中的CuCl2、FeCl3与铁粉反应生成Fe2+、Cu;CuCl2与铁粉反应的离子方程式为:Fe+Cu2+=Fe2++Cu;FeCl3与铁粉反应的离子方程式为:2Fe3+++Fe=3Fe2+,
故答案为:2Fe3++Fe=3Fe2+、Fe+Cu2+=Fe2++Cu;
(2)滤渣中含有Fe和Cu,若要除去其中的Fe选用盐酸,然后过滤,
故答案为:HCl;
(3)废腐蚀液加铁粉后,溶液为亚铁离子的溶液,通入氯气得到三氯化铁溶液,其反应的化学方程式为:2FeCl2+C12=2FeCl3,
故答案为:C12;2FeCl2+C12=2FeCl3.
点评 本题考查化学工艺流程、元素化合物性质等,掌握元素化合物的性质、混合物的分离、提纯方法是解决本题的关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 用CCl4萃取碘水中的I2 | B. | 粗盐(混有泥沙、MgSO4•FeCl3)的提纯 | ||
| C. | 用蒸馏方法分离CCl4和I2的混合物 | D. | 用浓HCl配制一定量浓度的稀HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等 | |
| B. | 根据反应过程中是否有氧原子的得失,将化学反应分为氧化还原反应和非氧化还原反应 | |
| C. | 根据化合物在水溶液或熔融状态是否能导电,将化合物分为电解质和非电解质 | |
| D. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制备有毒气体应在通风橱中进行,且对尾气进行吸收处理,防止中毒或污染大气 | |
| B. | 酒精灯不慎打翻小面积失火,可用湿抹布扑灭;实验室煤油大面积着火,可用水浇灭 | |
| C. | 氢气还原氧化铜,一般先预热氧化铜,然后通入氢气 | |
| D. | 实验室,少量浓硫酸溅到皮肤上,应立即用碳酸钠溶液冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
时间 浓度(mol?L-1) 温度 | 10min | 20min | 30min | 40min | 50min | 60min |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com