
 某课外兴趣小组欲利用如图所示装置自制氢氧燃料电池.
某课外兴趣小组欲利用如图所示装置自制氢氧燃料电池.分析 (1)按下开关S1,形成电解氢氧化钠的电解池,电解水;
(2)断开开关S1,按下开关S2,形成氢氧燃料电池,在电池的负极上燃料发生失电子的氧化反应.
解答 解:(1)按下开关S1,形成电解氢氧化钠的电解池,电解水,阳极上产生氧气,阴极上产生氢气,电解方程式为:2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2H2↑;
故答案为:2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2H2↑;
(2)断开开关S1,按下开关S2,形成氢氧燃料电池,有电流产生,所以会看到小灯泡发光,碳棒C1上产生的氧气作正极,碳棒C2上产生的氢气做负极,电极反应为:2H2-4e-+4OH-=4H2O,
故答案为:2H2-4e-+4OH-=4H2O.
点评 本题考查学生原电池、燃料电池的工作原理知识,明确电解池中阴阳极上离子的放电顺序和电极反应式的书写是关键,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 | |
| B. | MgO、Al2O3的熔点很高,可制作耐高温材料 | |
| C. | 二氧化硫具有漂白性,可用于漂白纸浆和草帽辫 | |
| D. | 铜盐能使蛋白质变性,游泳场馆常用硫酸铜作池水消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
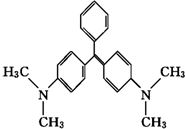 孔雀石绿是化工产品,具有较高毒性,高残留,容易致癌、致畸.其结构简式如图所示.下列关于孔雀石绿的说法正确的是( )
孔雀石绿是化工产品,具有较高毒性,高残留,容易致癌、致畸.其结构简式如图所示.下列关于孔雀石绿的说法正确的是( )| A. | 孔雀石绿的分子式为C23H25N2 | |
| B. | 1 mol孔雀石绿在一定条件下最多可与6 mol H2发生加成反应 | |
| C. | 孔雀石绿属于芳香族化合物 | |
| D. | 孔雀石绿苯环上的一氯取代物有6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30mL 3mol•Lˉ1的X溶液 | B. | 40mL 2mol•Lˉ1的X溶液 | ||
| C. | 20mL 4mol•Lˉ1的X溶液 | D. | 10mL 5mol•Lˉ1的X溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,32gO2和O3的混合气体所含原子数为2NA | |
| B. | 将7.1g氯气通入足量水中发生反应,所转移的电子数为0.1NA | |
| C. | 标准状况下,11.2LSO2中含有的分子数为0.5NA | |
| D. | 23g钠与足量氧气充分反应,转移的电子数一定是NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 分子式 | C3H8O | C4H8Cl2 | C7H16 | C8H10 |
| 限定条件 | 能使KMnO4溶液褪色 | 分子中含有2个甲基 | 分子中含有3个甲基 | 芳香烃、能得到三种一硝基化物 |
| 数目 | 2 | 3 | 2 | 3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com