
| 时间/min 浓度/mol•L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
| H2(g) | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
| CO2(g) | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
| CH2=CH2(g) | 0 | 0.10 | 0.15 | 0.50 | 0.60 | 0.60 |
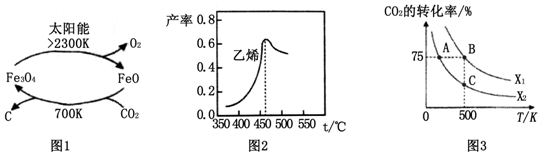
分析 (1)在700K条件下,CO2和FeO发生反应生成C和Fe3O4,过程1中Fe3O4分解生成FeO和O2,所以整个反应过程中FeO作催化剂,根据反应物和生成物及反应条件书写方程式;
(2)根据影响产物产率的因素只能是引起平衡移动的因素,根据平衡移动原理来解释;
(3)①相同条件下,投料比[X=$\frac{n({H}_{2})}{n(C{O}_{2})}$]越大,二氧化碳的转化率越大,据此判断X1、X2的相对大小;该反应的正反应是放热反应,温度越高其平衡常数越小;
②20~30min间氢气、CO的浓度都增大,且增大倍数相同,应为缩小容器体积;该温度下0~10min内H2浓度变化0.6mol/L,以此计算浓度.
解答 解:(1)在700K条件下,CO2和FeO发生反应生成C和Fe3O4,过程1中Fe3O4分解生成FeO和O2,所以整个反应过程中FeO作催化剂,根据反应物和生成物及反应条件书写方程式为CO2$\frac{\underline{\;太阳能\;}}{FeO}$C+O2,
故答案为:CO2$\frac{\underline{\;太阳能\;}}{FeO}$C+O2;
(2)影响产物产率的因素只能是引起平衡移动的因素,反应的活化能增大因素都是和催化剂有关的因素,催化剂只能改变反应速率,不会引起平衡移动,乙烯产率不会影响,反应的平衡常数变大是温度的变化引起的,反应是放热的,平衡常数变大是因为升高温度,不符合题意,
故选AC;
(3)①相同条件下,投料比[X=$\frac{n({H}_{2})}{n(C{O}_{2})}$]越大,二氧化碳的转化率越大,根据图知,相同温度下X1的转化率大于X2,所以X1>X2;该反应的正反应是放热反应,温度越高其平衡常数越小,温度A<B,所以平衡常数A>B,A、C温度相同,平衡常数相同,
故答案为:>; KA>KB=KC;
②20~30min间氢气、CO的浓度都增大,且增大倍数相同,应为缩小容器体积,该温度下0~10min内H2浓度变化0.6mol/L,则反应速率为$\frac{0.6mol/L}{10min}$=0.06mol•L-1•min-1,
故答案为:缩小容器体积; 0.06mol•L-1•min-1.
点评 本题考查化学平衡计算、化学平衡的影响因素等知识点,为高频考点,侧重考查学生分析计算能力,注意把握图象的分析,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑥ | B. | ①②⑤⑥ | C. | ①③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA | |
| B. | 标准状况下,2.24 LCCl4含有的共价键数为0.4NA | |
| C. | 1 L 0.1 mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1 NA | |
| D. | 14 g乙烯和丙烯混合气体中的氢原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L NO与11.2L O2混合充分反应,产物的分子数为NA | |
| B. | 14g乙烯和丙烯混合气体中含有C-H共价键的数目为2NA | |
| C. | l mol Cu与足量的硫充分反应,电子转移数为2NA | |
| D. | 100mL l mol•L-1KClO溶液中,阴离子的数目小于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直径介于1-100纳米之间的微粒称为胶体 | |
| B. | 当光束通过胶体时,看到的“光柱”是由于光被胶体粒子散射而形成的 | |
| C. | 胶体的分散质不能透过滤纸的孔隙 | |
| D. | 溶液时电中性的,胶体是带电的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4 L CO2含有的分子数为NA | |
| B. | 1mol•L-1的Ba(OH)2溶液中含有的氢氧根离子数目为2NA | |
| C. | 常温常压下,18 g H2O含有的氢原子数为2NA | |
| D. | 1mol Fe在足量的Cl2中充分燃烧,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCH3+所含的电子数为9NA | |
| B. | 标准状况下,11.2 L HF的分子数为0.5NA | |
| C. | 39 g Na2O2与足量水反应,转移电子数为NA | |
| D. | 1 mol乙醇中含有共用电子对数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯分子可表示为 ,其邻二氯代物有2种结构 ,其邻二氯代物有2种结构 | |
| B. | 等物质的量C2H4、C3H6完全燃烧,消耗等质量的O2 | |
| C. | 蛋白质的水解和油脂的皂化都是由高分子生成小分子的过程 | |
| D. | 利用CH4和Cl2的取代反应可制取溶剂CCl4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com