
根据下列有关图象,说法正确的是( )
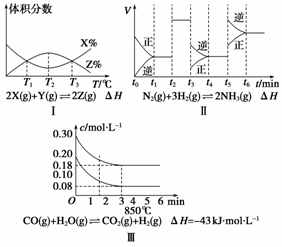
A.由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的ΔH<0
B.由图Ⅱ知,反应在t6时刻,NH3体积分数最大
C.由图Ⅱ知,t3时采取了增大反应体系压强的措施
D.图Ⅲ表示在10 L容器、850℃时的反应,由图知,到4 min时,反应放出51.6 kJ的热量
 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
化学上用“示踪原子法”来判断反应的历程,下列用“示踪原子
法”表示的化学方程式正确的是 ( )
A.5H218O2+2KMnO4+3H2SO4===518O2↑+K2SO4+2MnSO4+8H2O
B.CH3COOH+C2H518OH→CH3COOCH2CH3+H218O
C.2Na2O2+2H218O===4NaOH+18O2↑
D.K37ClO3+6HCl===K37Cl+3Cl2↑+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
往平底烧瓶中放入氢氧化钡晶体[Ba(OH)2·8H2O]和固态氯化铵晶体,塞紧瓶塞。在瓶底和木板间滴少量水,如下图所示。一会儿,就会发现瓶内固态物质变稀并有液体产生,瓶壁变冷,小木板上因少量水冻结而被烧瓶黏住,这时打开瓶塞,出来的气体有氨味。这是自发地发生了反应:Ba(OH)2·8H2O(s)+2NH4Cl(s)===BaCl2(s)+2NH3(g)+10H2O(l)
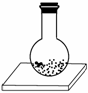
下列结论正确的是( )
A.自发反应一定是放热反应
B.自发反应一定是吸热反应
C.有的吸热反应也能自发进行
D.吸热反应不能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
由A、B两容器(如图所示),A容器固定,B容器可变。一定温度下,在A中加2 mol N2、3 mol H2发生反应:N2(g)+3H2(g)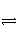
 2NH3(g),达到平衡时生成NH3的物质的量为n。
2NH3(g),达到平衡时生成NH3的物质的量为n。
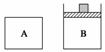
(1)相同温度下,在B中充入4 mol N2、6 mol H2,当B的压强与A的压强相等,B中反应达到平衡时,生成NH3的物质的量________2n(填“>”、“<”或“=”);当B的体积与A的体积相等,B中反应达到平衡时,生成NH3的物质的量______2n(填“>”、“<”或“=”)。
(2)相同温度下,保持B的容积为A的一半,并加入1 mol NH3,要使B中反应达到平衡时各物质的量分别与上述A容器中平衡时相同,则起始时应加入______mol N2和______mol H2。
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中进行如下反应:H2(g)+I2(g)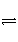
 2HI(g)。在温度T1和T2时,产物的量与反应时间的关系如图所示。符合图所示的正确判断是( )
2HI(g)。在温度T1和T2时,产物的量与反应时间的关系如图所示。符合图所示的正确判断是( )
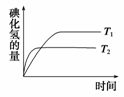
A.T1>T2,ΔH>0 B.T1>T2,ΔH<0
C.T1<T2,ΔH>0 D.T1<T2,ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对葡萄糖的叙述错误的是( )
A.葡萄糖是一种多羟基醛
B.葡萄糖是一种重要的营养物质
C.葡萄糖能水解生成乙醇
D.葡萄糖是一种还原性糖,能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不属于蛋白质变性的是( )
A.农业上用波尔多液(由硫酸铜、生石灰和水制成)消灭病虫等
B.蛋白质溶液加入氯化镁产生沉淀
C.用甲醛溶液浸泡动物标本
D.打针时用75%的乙醇溶液消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
氯仿(CHCl3)可以作麻醉剂,但常因保存不妥而被空气中的O2氧化,生成剧毒的光气(COCl2),发生反应的化学方程式为2CHCl3+O2→2HCl+2COCl2,为了防止事故的发生,使用前应先检验氯仿是否变质,应选用的试剂是( )
A.NaOH溶液 B.AgNO3溶液
C.溴水 D.淀粉KI试剂
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学科研小组的同学查阅材料,得到如下材料:
酸雨是指pH小于5.6的各种大气降水,酸雨的形成是大气受污染的产物和表现。酸雨中含有多种无机酸和有机酸,多数情况下以硫酸为主。燃料燃烧、火山喷发、枯死植物腐烂、从含硫的金属矿石中提炼金属和生产硫酸的过程中都会产生二氧化硫,二氧化硫在空气中、云中发生化学反应形成硫酸。北京地区有效地控制了酸雨的形成,防止了酸雨的危害。
请你仔细阅读以上材料,回答下列问题:
(1)以上述材料中,哪些是属于引起酸雨的人为因素?
________________________________________________________________________________________________________________________________________________。
(2)用化学方程式表示SO2形成酸雨的过程________________________________________________________________________________________________________________________________________________。
(3)某工厂的燃料煤中硫的质量分数为0.32%,该厂每天烧这种煤100 t。
①有人设计向该厂燃料中掺入生石灰,可排除SO2的污染,试写出有关的化学方程式_________________________________。
②若不采取作何措施,每天该工厂排出SO2________________L。(标准状况)
③若将煤中的硫转化为硫酸(设硫的转化率为80%),每天可制得98%(质量分数)的硫酸________________t。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com