
| A. |  | B. |  | C. | 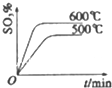 | D. |  |
分析 已知2SO2(g)+O2(g)?2SO3(g)△H=-196kJ•mol-1,该反应正方向为:体积减小,放热反应;结合温度、压强对速率和平衡的影响分析.
解答 解:已知2SO2(g)+O2(g)?2SO3(g)△H<0,该反应正方向为:体积减小,放热反应;
A、升高温度平衡逆移,所以逆速率大于正速率,与图象相符,故A正确;
B、随着反应进行三氧化硫的含量逐渐增大,当达到平衡时,再升高温度,平衡逆移,所以三氧化硫含量减小,与图象相符,故B正确;
C、升高温度,平衡逆移,所以三氧化硫含量减小,温度高反应速率快,达到平衡所需时间短,所以600℃的曲线应该在下面,故C错误;
D、该反应正方向为:体积减小的方向,增大压强,平衡正移,三氧化硫的含量增大,所以压强大的曲线在上面,故D正确;
故选C.
点评 本题考查了温度、压强对速率和平衡的影响等知识点,难度较大,掌握移动原理是解题关键.


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:填空题
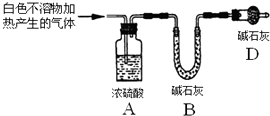
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验I中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | 气体成分为 氢气 |
| 实验Ⅲ | 取实验I中的白色不溶物,洗涤, 加入足量稀盐酸 | 产生气泡沉淀全部溶解 | 白色不溶物可能含有MgCO3 |
| 实验Ⅳ | 取实验I中的澄清液,向其中加 入少量CaCl2稀溶液 | 产生白色沉淀 | 溶液中存在④ CO32-离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①中的为气态.②中的为固态 | |
| B. | ①的反应物总能量比②的反应物总能量低 | |
| C. | ①的产物比反应②的产物热稳定性更好 | |
| D. | 1mol固态碘升华时将吸热17kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg变为MgO时化合价升高,故Mg在该反应中作还原剂 | |
| B. | 在反应2H2S+SO2═3S+2H2O中,氧化产物和还原产物都是S | |
| C. | 凡是置换反应都是氧化还原反应 | |
| D. | 在反应2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑中,H2是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
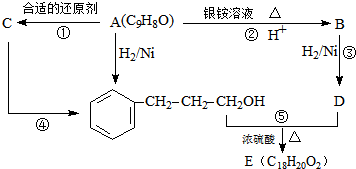
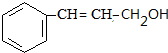 .
.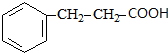 +
+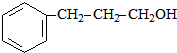 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$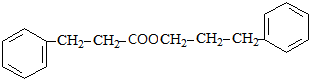 +H2O.
+H2O.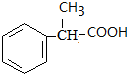 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ${\;}_{49}^{115}$In原子核外有49个电子 | |
| B. | ${\;}_{49}^{115}$In是In元素的一种核素 | |
| C. | ${\;}_{49}^{115}$In原子核内质子数和中子数之差等于17 | |
| D. | ${\;}_{49}^{115}$In原子核内有49个中子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com