
A、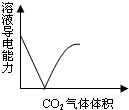 CO2通入澄清石灰水 |
B、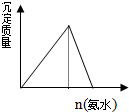 明矾中加入氨水 |
C、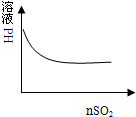 氯水中通入SO2 |
D、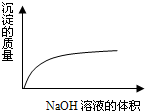 NaOH溶液滴入Ba(HCO3)2溶液 |


 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| A、①② | B、①③ | C、①④ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al(OH)3沉淀 |
| B、只有[Al(OH)4]- |
| C、Al(OH)3沉淀和Al3+ |
| D、Al(OH)3沉淀和[Al(OH)4]- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、②③ |
| C、④⑤ | D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
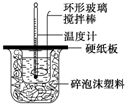 某实验小组设计用50mL1.0mol/L盐酸跟50mL1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL1.0mol/L盐酸跟50mL1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、在汽车加油站见到的油罐车上贴有如右图的标志 |
| B、节日期间,在开阔的广场燃放烟花爆竹 |
| C、用点燃的火柴在液化气钢瓶口检验是否漏气 |
| D、进入煤矿井时,用火把照明 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v正(X)=v逆(Z) |
| B、容器内X、Y、Z的浓度之比为1:2:2 |
| C、容器内压强不随时间变化 |
| D、单位时间消耗0.1molX同时生成0.2molZ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com