
| 元素符号 | Li | Be | B | C | N | O | F | Na | Mg | Al | P | S |
| X值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.04 | 3.44 | 3.98 | 0.93 | 1.31 | 1.61 | 2.19 | 2.58 |
 ,故答案为:
,故答案为: ;
; 

科目:高中化学 来源: 题型:
| ||
| ||
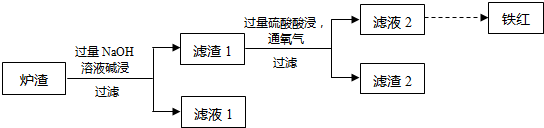
查看答案和解析>>
科目:高中化学 来源: 题型:
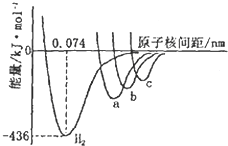 X元素在第3周期中电负性最大,Y、Z元素同主族且位置相邻,Y原子的最外层电子排布为nsnnpn+2.请填写下列空白.
X元素在第3周期中电负性最大,Y、Z元素同主族且位置相邻,Y原子的最外层电子排布为nsnnpn+2.请填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:
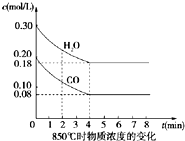 在一体积为10L密闭的容器中,通入一定量的CO和H2O(g),在850℃时发生以下反应:
在一体积为10L密闭的容器中,通入一定量的CO和H2O(g),在850℃时发生以下反应:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu+HNO3(浓)→Cu(NO3)2 | |||||
| B、Cu+HNO3(稀)→Cu(NO3)2 | |||||
C、Cu
| |||||
D、Cu
|
查看答案和解析>>
科目:高中化学 来源: 题型:
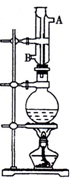 实验室利用如图中装置制取乙酸异戊酯,其合成过程为:
实验室利用如图中装置制取乙酸异戊酯,其合成过程为:查看答案和解析>>
科目:高中化学 来源: 题型:
| D |
| D |
| A、3 | B、4 | C、5 | D、6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com