
| A. | c (H+)>10-7 mol/L>c (OH-) pH<7 显中性 | |
| B. | c (H+)=c (OH-)>10-7 mol/L pH<7 显中性 | |
| C. | c (H+)>10-7 mol/L>c (OH-) pH<7 显酸性 | |
| D. | c (H+)=c (OH-)>10-7 mol/L pH=7 显中性 |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
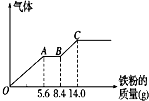 向 100mL 某稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的量(相同状况)随铁粉 质量增加的变化如图所示(已知硝酸只被还原为 NO 气体).下列分析或结果错误的是( )
向 100mL 某稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的量(相同状况)随铁粉 质量增加的变化如图所示(已知硝酸只被还原为 NO 气体).下列分析或结果错误的是( )| A. | OA 段产生的是 NO,BC 段产生氢气,溶液中最终溶质为 FeSO4 | |
| B. | AB 段的反应为 Fe+2Fe3+═3Fe2+, | |
| C. | 原混合酸中NO3-物质的量为 0.3mol | |
| D. | H2SO4 浓度为 2.5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取少量晶体放入试管中,加热,若试管口上蘸有少量无水硫酸铜粉末的脱脂棉变蓝,则可证明晶体中含有结晶水 | |
| B. | 取少量晶体溶于水,加入少量NaOH溶液,加热,在试管口用湿润的蓝色石蕊试纸检验,若变红,则可证明晶体的成分中含有NH4+ | |
| C. | 取少量晶体溶于水,加适量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42- | |
| D. | 取少量晶体溶于水,用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,不能证明晶体中无K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 滴定前 | 第一次终点 | 第二次终点 | 第三次终点 | |
| 滴定管 液面刻度 | 0.00mL | 16.02mL | 16.00mL | 16.01mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在FeSO4溶液中滴入KSCN溶液,溶液显红色 | |
| B. | 铁位于元素周期表中第4周期第Ⅷ族 | |
| C. | 在化合物中,铁通常呈现为+2,+3价 | |
| D. | 通常情况下,铁丝在氯气里燃烧时生成FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 NH4++NH2-.
NH4++NH2-. NH3•H2O+H+.
NH3•H2O+H+.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①>②>③>④ | B. | ②>①>④>③ | C. | ②>①>③>④ | D. | ④>③>①>② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com