
【题目】利用化学反应原理回答下列问题:
(1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示,其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。
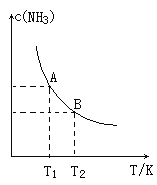
①该反应的焓变△H__0(填“>”或“<”)判断依据为_____。
②该反应在T1温度下5.00min达到平衡,这段时间内N2的化学反应速率为______。
③T1温度下该反应的化学平衡常数K1=______。
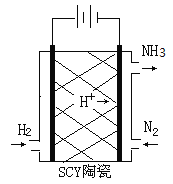
(2)科学家采用质子高导电性的SCY陶瓷(可传递H+)实现了低温常压下高转化率的电化学合成氨,其实验原理示意图如图所示,则阴极的电极反应式是____________。
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
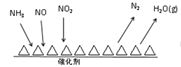
①SCR技术中的氧化剂为__________________。
②当NO2与NO的物质的量之比为1∶1时,与足量氨气在一定条件下发生反应。该反应的化学方程式为_______________。当有3 mol电子发生转移时,则参与反应的NO的物质的量为____________。
【答案】< 温度升高,氨气的浓度降低,说明正反应为放热反应 8.00×10﹣3mol/(Lmin) 18.3 N2+6H++6e﹣=2NH3 NO、NO2 2NH3+NO2+NO=2N2+3H2O 0.5 mol
【解析】
(1)①由图可知,温度越高,平衡时NH3的浓度越小,说明升高温度,化学平衡向逆反应方向移动,平衡常数减小;
②根据化学反应速率的计算公式带入数据即可;
③根据K=c2(NH3)/c(N2)c3(H2)计算平衡常数;
(2)根据阴极发生得到电子的还原反应;
(3)①根据图以及氧化还原反应间的关系进行判断;
②根据化合价进行分析。
(1)①根据图像中氨气的平衡含量与温度的关系可知:升高温度,氨气的平衡浓度降低,说明升高温度,化学平衡向逆反应方向移动,说明该反应的正反应放热反应。当温度由T1变化到T2时,平衡常数关系K1>K2;由于该反应的正反应是放热反应,所以△H<0,故答案为:<;温度升高,氨气的浓度降低,说明正反应为放热反应。
②该反应在T1温度下5.0min达到平衡,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,根据反应方程式N2(g)+3H2(g)=2NH3(g)可知:每有1molN2发生反应会产生2molNH3,气体的物质的量减少2mol,假设反应的氮气的物质的量是x,则反应的氢气的物质的量是3x,反应产生2x,反应后的气体的物质的量减小2x,反应后混合气体的总物质的量是(1mol+3mol-2xmol),其中温度为T1时平衡混合气体中氨气的体积分数为25.0%,2x÷(1mol+3mol-2xmol)=25.0%,解得x=0.4mol,则这段时间内N2的化学反应速率为0.4mol÷10L÷5.0min=8.00×10﹣3mol/(Lmin),故答案为:8.00×10﹣3mol/(Lmin)。
③T1温度下,反应处于平衡状态时,c(NH3)=0.8mol÷10.0L=0.08mol/L,c(N2)=(1mol-0.4mol)÷10.0L=0.06mol/L;c(H2)=(3mol-3×0.4mol)÷10.0L=0.18mol/L,则根据化学平衡常数的含义可得该反应的化学平衡常数K1=c2(NH3)/c(N2)c3(H2)=0.082/0.06×0.183=18.3,故答案为:18.3。
(2)电解池中阴极发生得到电子的还原反应,则阴极是氮气得到电子结合氢离子转化为氨气,电极方程式为:N2+6H++6e﹣=2NH3,故答案为:N2+6H++6e﹣=2NH3。
(3)①由反应原理图可知SCR技术中,反应物是NH3与NO、NO2,产物为N2和水,氮氧化物中N元素化合价由正化合价变为0价、氨气中N元素化合价由-3价变为0价,故氧化剂为NO、NO2,故答案为:NO、NO2。
②NH3中氮的化合价由-3价升高到0价,一个NH3失去3个电子,NO2中氮的化合价由+4价降低到0价,一个NO2得到4个电子,NO中氮的化合价由+2价降低到0价,一个NO得到2个电子,当NO2与NO的物质的量之比为1:1时,转移电子的最小公倍数为6,结合质量守恒可知方程式为:2NH3+NO2+NO=2N2+3H2O,当有3 mol电子发生转移时,则参与反应的NO的物质的量为0.5mol,故答案为:2NH3+NO2+NO=2N2+3H2O;0.5 mol。


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值,下列有关叙述正确的是
A. 将78gNa2O2与过量CO2反应转移的电子数为2NA
B. 1mol N2与 4mol H2反应生成的NH3分子数为2NA
C. 标准状况下,2.24L SO3中所含原子数为0.4 NA
D. 标准状况下,18g D2O中所含电子数为9 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图(1)和图(2)是A、B两种物质的核磁共振氢谱。已知A、B两种物质都是烃类,都含有6个氢原子。请根据图(1)和图(2)两种物质的核磁共振氢谱图选择出可能属于图(1)和图(2)的两种物质( )

A. A是C3H6;B是C6H6
B. A是C2H6;B是C3H6
C. A是C2H6;B是C6H6
D. A是C3H6;B是C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】17.1 g物质A在氧气中充分燃烧有白雾现象,产物有三种,其中CO2和H2O的质量比为44:9。将等质量的A与钠混合熔融,把产物溶于足量稀硝酸后,加入足量AgNO3溶液,得到18.8 g淡黄色沉淀。物质A的蒸气对相同条件下氢气的相对密度为85.5。已知它不能使溴的CCl4溶液褪色,但能使酸性KMnO4溶液褪色。写出A的结构简式。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在科学史上中国有许多重大的发明和发现,它们为世界的现代化奠定了基础,以下发明和发现属于化学史上中国对世界的贡献的是( )
①火药 ②指南针 ③造纸 ④印刷技术 ⑤炼铜、炼铁、炼钢 ⑥合成有机高分子材料 ⑦人工合成蛋白质 ⑧提出原子-分子学说
A.②③⑥⑧B.①③⑤⑦C.④⑤⑦⑧D.①③④⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近发现两种粒子:第一种是由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”;第二种是由四个氧原子构成的分子。下列有关这两种粒子的说法正确的是
A. “四中子”的粒子不显电性 B. “四中子”的电子数为4
C. 第二种粒子与O2互为同分异构体 D. 第二种粒子的晶体类型属于原子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰基烯酸酯在碱性条件下能快速聚合为 ,从而具有胶黏性,某种氰基丙烯酸酯(H)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(H)的合成路线如下:

已知:①A的相对分子量为58,氧元素质量分数为0. 276,核磁共振氢谱显示为单峰;

回答下列问题:
(1)A的化学名称为____________。
(2)G的结构简式为________________,G中的含氧官能团是________________。(填官能团名称)
(3)由B生成C的反应类型为_______________,由C生成D的反应类型为_____________。
(4)由E生成F的化学方程式为________________________________。
(5)H的同分异构体中,含有酯基,能发生银镜反应、核磁共振氢谱之比是1:1:3的同分异构体结构简式_____________________________________________。(写两种即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应X(g)+Y(g)![]() R(g)+Q(g)的平衡常数与温度的关系如表所示。830 ℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005 mol/(L·s)。下列说法正确的是
R(g)+Q(g)的平衡常数与温度的关系如表所示。830 ℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005 mol/(L·s)。下列说法正确的是
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
A. 4 s时容器内c(Y)=0.76 mol/L
B. 830 ℃达平衡时,X的转化率为80%
C. 反应达平衡后,升高温度,平衡正向移动
D. 1 200 ℃时反应R(g)+Q(g) ![]() X(g)+Y(g)的平衡常数K=0.4
X(g)+Y(g)的平衡常数K=0.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某含Br—废水中提取Br2的过程包括:过滤、氧化、萃取(需选择合适萃取剂)及蒸馏等步骤。已知:
物质 | Br2 | CCl4 | 正十二烷 |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
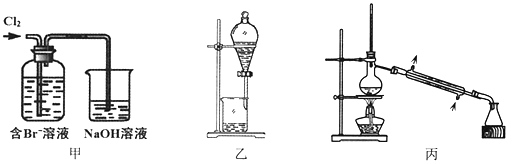
下列说法不正确的是
A. 甲装置中Br—发生的反应为:2Br-+ Cl2 = Br2 + 2Cl-
B. 甲装置中NaOH溶液每吸收0.1mol Cl2,转移0.1mol e—
C. 用乙装置进行萃取,溶解Br2的有机层在下层
D. 用丙装置进行蒸馏,先收集到的是Br2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com