
���� ��1��˫��ˮ����������˵��˫��ˮ��Ԫ�ػ��ϼ����ߣ����ֻ�ԭ��˵��˫��ˮ��Ԫ�ػ��ϼ۽��ͣ������������������ֻ�ԭ��˵�����ϼۼ������ֽ��ͣ�
��2���������������ԣ���������������ԣ���ԭ���������ԣ�
��3����H2O2ֻ������H2O2��O2�ı仯������˫��ˮ�Ļ�ԭ�ԣ�����ԭ����
�ڸ����������ķ�Ӧ���������ϼ۵ı仯����������õ�ת�Ƶ��ӵ���Ŀ��
��4������ԭ���غ���ȷ�����ʵĻ�ѧʽ��˫��ˮ���������Ļ�ԭ����Ϊˮ������Ⱦ���
��� �⣺��1��D��˫��ˮ����Ԫ�ػ��ϼ۽��ͣ�˵��˫��ˮ���������������������ԣ�B��˫��ˮ����Ԫ�ػ��ϼ����ߣ����ֻ�ԭ�ԣ�C��˫��ˮ����Ԫ�ػ��ϼۼ������ֽ��ͣ������������������ֻ�ԭ�ԣ��ʴ�Ϊ��D��B��C��
��2����ӦAg2O+H2O2=2Ag+O2��+H2O�У�����������������˫��ˮ����ԭ������������Ag2O��H2O2����Ӧ3H2O2+Cr2��SO4��3+10KOH=2K2CrO4+3K2SO4+8H2O�У�˫��ˮ��������������������������������H2O2��K2CrO4����������˳��Ϊ��Ag2O��H2O2��K2CrO4��
�ʴ�Ϊ��Ag2O��H2O2��K2CrO4��
��3����H2O2ֻ������H2O2��O2�ı仯������˫��ˮ�Ļ�ԭ�ԣ�����ԭ�������Ը������������������ԭ�����������ӣ�Ҫ�����Dz����л�ԭ�Ե�ǿ�ᣬ����ѡ��ϡ���ᣬ��Ũ�������ǿ�����ԣ���Ӧ��Ҫ���������������£�
�ʴ�Ϊ��C��
��˫��ˮ��-1�۵�����Ϊ�����е�0�ۣ�������6.72L����״������0.3mol����ʱ����ʧ������ĿΪ��0.3mol��2����1-0��=0.6mol��
�ʴ�Ϊ��0.6��
��4����ӦKCN+H2O2+H2O=A+NH3����ѭԭ���غ㣬����AΪKHCO3��˫��ˮ���������Ļ�ԭ����Ϊˮ������Ⱦ���ʴ�Ϊ��KHCO3��H2O2�����������仹ԭ������ˮ��ˮû�ж��Լ���Ⱦ�ԣ�
���� ������һ���й�������ԭ��Ӧ֪ʶ���ۺ�����Ŀ��ע��Ԫ�ػ��ϼ۵��жϣ���Ŀ��Ϊ�ۺϣ��Ѷ��еȣ�˼ά������


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Al��Cu��ϡH2SO4���ԭ��أ��ŵ�ʱSO42-��Al�缫�ƶ� | |
| B�� | ��Mg��Al��NaOH��Һ���ԭ��أ��为����ӦʽΪ��Al-3e-+3OH-�TAl��OH��3 | |
| C�� | ��Fe��Cu��FeCl3��Һ���ԭ��أ��为����ӦʽΪ��Fe-3e-�TFe3+ | |
| D�� | ��Al��Cu��Ũ�������ԭ�������Դ����ʯī�缫�����500mL��������Һ��������ͭ�缫32 gʱ��������Һ��pH=2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʳ�� | B�� | �״� | C�� | С�մ� | D�� | �ռ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 10 mL18.4mol•L-1Ũ����������п��Ӧ��ת�Ƶ�����Ϊ0.184NA | |
| B�� | 0.1 mol24Mg18O������������������Ϊ2.0 NA | |
| C�� | �ڱ�״���£�2.8g N2��2.24L CO������������Ϊ1.4NA | |
| D�� | 1 L 1 mol•L-1��NaClO��Һ�к���ClO-����ĿΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C3H8��l��+5O2��g���T3CO2��g��+4H2O��l����H=-2219.9 kJ/mol | |
| B�� | 2CO��g��+O2��g���T2CO2��g����H=-566.0 kJ/mol | |
| C�� | H2��g��+$\frac{1}{2}$O2��g���TH2O��g����H=-241.8 kJ/mol | |
| D�� | 2C��s��+O2��g���T2CO��g����H=-221 kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | $\frac{b}{4a}$mol-1 | B�� | $\frac{a}{4b}$mol-1 | C�� | $\frac{a}{b}$ mol-1 | D�� | $\frac{b}{a}$mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
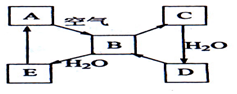 ��ͼ��ʾij����ɫ��̬����A���仯����֮���ת����ϵ��ijЩ����ͷ�Ӧ��������ȥ����������B�ڳ��³�ѹ��Ϊ���壬B��C���е�Ԫ��������ͬ������Է�������֮��Ϊ4��5��������D����Ҫ�Ĺ�ҵԭ�ϣ�
��ͼ��ʾij����ɫ��̬����A���仯����֮���ת����ϵ��ijЩ����ͷ�Ӧ��������ȥ����������B�ڳ��³�ѹ��Ϊ���壬B��C���е�Ԫ��������ͬ������Է�������֮��Ϊ4��5��������D����Ҫ�Ĺ�ҵԭ�ϣ��鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com