
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将SO2通入酸性高锰酸钾溶液 | 高锰酸钾溶液紫色褪色 | SO2具有漂白性 |
| B | 等体积pH=3的HA和HB两种酸分别与足量的锌反应 | 相同时间内HA与Zn反应生成的氢气更多 | HA是强酸 |
| C | 灼烧某白色粉末 | 火焰呈黄色 | 白色粉末中含有Na+,无K+ |
| D | 将稀硫酸滴入碳酸钠溶液中产生的气体通入硅酸钠溶液中 | 有白色沉淀生成 | 证明非金属性S>C>Si |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化硫具有还原性;
B.pH=3的两种酸,相同时间内,HA放出的氢气多,则反应过程中HA酸的氢离子浓度大;
C.不能确定是否含有K+;
D.根据强酸准备弱酸.
解答 解:A.酸性高锰酸钾溶液具有强氧化性,二氧化硫具有还原性,二氧化硫和酸性高锰酸钾溶液发生氧化还原反应,所以该反应体现二氧化硫还原性,故A错误;
B.等体积pH=3的HA和HB两种酸分别与足量的锌反应,相同时间内,HA收集到氢气多,一定能说明HA是弱酸,故B错误;
C.不能确定是否含有K+,检验钾离子,可透过蓝色钴玻璃,以滤去黄光,故C错误;
D.稀H2SO4与Na2CO3溶液反应后产生二氧化碳,酸性硫酸大于碳酸,二氧化碳溶于水生成碳酸,通入Na2SiO3溶液中产生白色浑浊,说明生成硅酸,则酸性:H2CO3>H2SiO3,符合强酸准备弱酸的特点,故D正确.
故选D.
点评 本题考查较为综合,涉及氧化还原反应、弱电解质、焰色反应以及非金属性比较,综合考查学生的分析能力、实验能力和评价能力,为高考常见题型,注意把握物质的性质的异同以及实验的严密性和可行性的评价,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA | |
| B. | 标准状况下,11.2 LSO3含有的分子数目为0.5 NA | |
| C. | 7.8gNa2O2所含的离子数为0.4NA | |
| D. | 11.2LCl2完全溶于NaOH溶液,电子转移数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- | |
| B. | 常温下pH=12的溶液:Na+、K+、SiO32-、NO3- | |
| C. | c(Fe3+)=0.1mol•L-1的溶液:H+、Al3+、I-、SCN- | |
| D. | 加入铝粉生成H2的溶液:K+、Mg2+、SO42-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

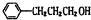 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O;该反应的反应类型为酯化反应或取代反应
+H2O;该反应的反应类型为酯化反应或取代反应 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
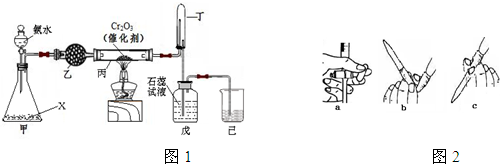
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| F | Cl | Br | I | |
| 第一电离能((kJ•mol-1)) | 1681 | 1251 | 1140 | 1008 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
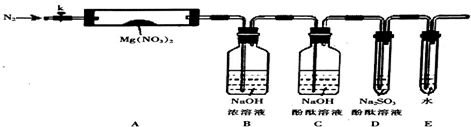
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2OH+CH3COOH $→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| B. | CH2=CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl | |
| C. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.5 mol/(L•s) | B. | v(B)=0.005 mol/(L•s) | ||
| C. | v(C)=0.8 mol/(L•min) | D. | v(D)=1.0 mol/(L•min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com