
 )的废水可以利用微生物电池除去,其原理如图所示.
)的废水可以利用微生物电池除去,其原理如图所示.
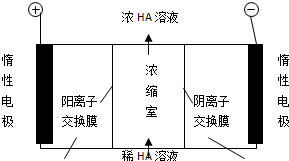
| ||
| ||
 -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-,故答案为:Cl-
-OH+Cl-,故答案为:Cl- -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-;
-OH+Cl-;| 1 |
| 2 |
| 145g?L -1-10g?L -1 |
| 90g/mol |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.01mol?L-1 |
| B、0.017mol?L-1 |
| C、0.05mol?L-1 |
| D、0.50mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧气的摩尔质量为32g |
| B、1molH2SO4的质量98 |
| C、H2O的摩尔质量18g?mol-1 |
| D、1molCH4体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、在蒸馏烧瓶中盛约
| ||
| B、将温度计水银球插到蒸馏烧瓶自来水中 | ||
| C、冷水从冷凝管下口入,上口出 | ||
| D、收集到的液体取少量滴入硝酸银和稀硝酸,无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | N(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | N(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
| A、10min内,T1时CH4的化学反应速率比T2时小 |
| B、T1<T2 |
| C、平衡常数:K(T1)<K(T2) |
| D、a<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com