
| A. | ②③④⑤⑥① | B. | ③④②⑤① | C. | ③②④⑥⑤① | D. | ④③⑥⑤① |
分析 得到纯净的NaCl固体,除去可溶性杂质CaCl2、MgCl2和Na2SO4,选择NaOH除去MgCl2,选择BaCl2除去Na2SO4,选择Na2CO3除去CaCl2,且Na2CO3一定在BaCl2之后,过滤后加盐酸即可,以此来解答.
解答 解:得到纯净的NaCl固体,除去可溶性杂质CaCl2、MgCl2和Na2SO4,选择NaOH除去MgCl2,选择BaCl2除去Na2SO4,选择Na2CO3除去CaCl2,且Na2CO3一定在BaCl2之后,过滤后加盐酸、蒸发结晶得到NaCl,则实验操作顺序是③②④⑥⑤①或②③④⑥⑤①,
故选C.
点评 本题考查混合物分离提纯实验设计,为高频考点,把握物质的性质、发生的反应、混合物分离为解答的关键,侧重分析与实验能力的综合考查,注意碳酸钠可除去过量的钡离子,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
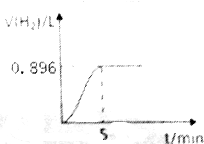 取1.27g钠铝合金放入50mL水中,充分反应后有固体剩余,其产生气体的体积随时间的变化曲线如图所示(气体体积已折算成标准状况),按要求回答下列问题:
取1.27g钠铝合金放入50mL水中,充分反应后有固体剩余,其产生气体的体积随时间的变化曲线如图所示(气体体积已折算成标准状况),按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3•H2O溶液的c(OH-)<NaOH溶液的c(OH-) | |
| B. | c(Na+)=c(NH4+) | |
| C. | 等体积的氢氧化钠和氨水溶液与足量盐酸完全反应,NaOH消耗的盐酸体积多 | |
| D. | 将等体积的氢氧化钠和氨水溶液加水稀释相同倍数,NaOH溶液的pH大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氮气的转化率减小 | |
| B. | 氢气的转化率增大 | |
| C. | 氨气在平衡混合气体中的百分含量一定增大 | |
| D. | 氨气的分解速率大于氨气的生成速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q2>Q1>57.3 | B. | Q1=57.3<Q2 | C. | Q2>57.3>Q1 | D. | Q2=57.3>Q1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
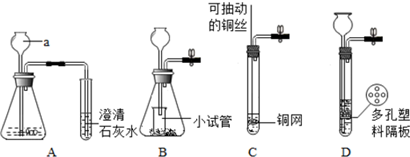
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
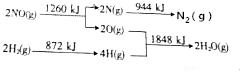
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com