



 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 温度(℃) | 60 | 240 | 930 | 1000 |
| 残留固体质量(g) | 19.7 | 16.1 | 8.1 | 8.1 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2013届湖北省黄冈中学高三10月月考化学试卷(带解析) 题型:填空题
(9分)化学实验室通常用粗锌和稀硫酸反应制氢气,因此在制氢废液中含有大量的硫酸锌。同时,由于粗锌中还含有铁等杂质,使得溶液中混有一定量的硫酸亚铁,为了充分利用制氢废液,常用其制备皓矾(ZnSO4·7H2O)。某校化学兴趣小组的同学以制氢气的废液为原料来制取皓矾。制备皓矾的实验流程如下图所示。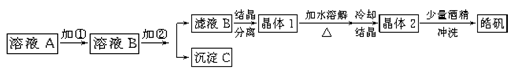
已知:开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:Fe(OH)3:2.7-3.7 Fe(OH)2:7.6-9.6 Zn(OH)2:5.7-8.0试回答下列问题:?
(1)加入的试剂①,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,最好选用 ,其理由是 ;
(2)加入的试剂②,供选择使用的有:a、Zn粉,b、ZnO,c、Zn(OH)2,d、ZnCO3,e、ZnSO4等,可选用 ;
(3)从晶体1→晶体2,该过程的名称是 ;
(4)在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年安徽省高三上学期第二次模化学试卷(解析版) 题型:填空题
(10分)化学实验室通常用粗锌和稀硫酸反应制氢气,因此在制氢废液中含有大量的硫酸锌。同时,由于粗锌中还含有铁等杂质,使得溶液中混有一定量的硫酸亚铁,为了充分利用制氢废液,常用其制备皓矾(ZnSO4·7H2O)。某校化学兴趣小组的同学以制氢气的废液为原料来制取皓矾。制备皓矾的实验流程如下图所示。
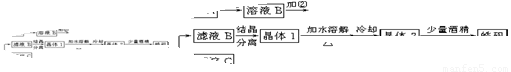
已知:开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:Fe(OH)3:2.7-3.7
Fe(OH)2:7.6-9.6 Zn(OH)2:5.7-8.0试回答下列问题:?
(1)加入的试剂①,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,最好选用 ,其理由是 ;
(2)加入的试剂②,供选择使用的有:a、Zn粉,b、ZnO,c、Zn(OH)2,d、ZnCO3,e、ZnSO4等,可选用 ;
(3)从晶体1→晶体2,该过程的名称是 ;
(4)在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省高三10月月考化学试卷(解析版) 题型:填空题
(9分)化学实验室通常用粗锌和稀硫酸反应制氢气,因此在制氢废液中含有大量的硫酸锌。同时,由于粗锌中还含有铁等杂质,使得溶液中混有一定量的硫酸亚铁,为了充分利用制氢废液,常用其制备皓矾(ZnSO4·7H2O)。某校化学兴趣小组的同学以制氢气的废液为原料来制取皓矾。制备皓矾的实验流程如下图所示。
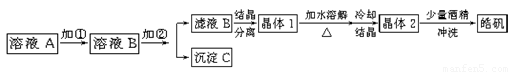
已知:开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:Fe(OH)3:2.7-3.7 Fe(OH)2:7.6-9.6 Zn(OH)2:5.7-8.0试回答下列问题:?
(1)加入的试剂①,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,最好选用 ,其理由是 ;
(2)加入的试剂②,供选择使用的有:a、Zn粉,b、ZnO,c、Zn(OH)2,d、ZnCO3,e、ZnSO4等,可选用 ;
(3)从晶体1→晶体2,该过程的名称是 ;
(4)在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com