
| A、强碱性溶液中:K+、Cl-、SO42-、Al3+ |
| B、含有0.1mol/L Fe3+的溶液中:I-、SO42-、K+、Mg2+ |
| C、与铝反应能放出大量氢气的溶液中:Na+、SO42-、CO32-、Cu2+ |
| D、在无色酸性溶液中:Ca2+、Cl-、NO3-、K+ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
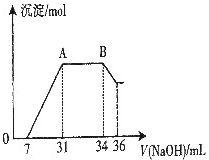 某同学通过查阅资料得知:铝和氧化铁在高温下反应所得到的熔融物应该是铁铝合金.
某同学通过查阅资料得知:铝和氧化铁在高温下反应所得到的熔融物应该是铁铝合金.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在标准状况下,含有NA个原子的氮气体积为22.4L |
| B、1mol Fe全部转化为Fe2+时,失去电子2NA个 |
| C、100℃时的水蒸气11.2L中含有氢原子NA个 |
| D、含有0.5NA个O2的总质量为8g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、ClO-、Cl-、SO42- |
| B、Na+、K+、Ba2+、AlO2- |
| C、Fe3+、NH4+、SiO32-、Cl- |
| D、Na+、K+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 短周期元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A、氢化物的沸点为H2T<H2R |
| B、单质与稀盐酸反应的剧烈程度为L<Q |
| C、M与T形成的化合物具有两性 |
| D、L2+离子半径比T2-离子半径小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去乙烷中含有的乙烯:将气体通入溴水中,洗气 |
| B、检验蔗糖是否水解:取1mL 20%的蔗糖溶液,加3~5滴稀硫酸.水浴加热5min后取少量溶液,加氢氧化钠溶液调溶液pH至碱性,再加入少量新制备的Cu(OH)2,加热3~5 min,观察实验现象 |
| C、除去乙酸乙酯中的乙酸:加入浓硫酸和乙醇,加热 |
| D、鉴别己烯和苯:将溴的四氯化碳溶液分别滴加到少量己烯和苯中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容器内每减少1mol A2,同时消耗2mol AB3 |
| B、容器内nA2:nB2:nAB3=1:3:2 |
| C、混合气体总的物质的量 |
| D、容器内的气体密度不再改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com