
����Ŀ�����Ļ�������ũҩ��������ҵ����ҵ��������;�dz��㷺���������ʾ�ش�����������⣺
��1����̬��ԭ�ӵļ۲�����Ų�ʽΪ__________________��̼��������Ԫ�صĵ�һ��������С�����˳��Ϊ_________________����Ԫ�ط��ű�ʾ����
��2��NH4Cl�е�ԭ�ӵ��ӻ���ʽΪ____________����NH4����Ϊ�ȵ������һ�ַǼ��Է��ӵĻ�ѧʽΪ_______________��
��3��NH4Cl�����ֽ������������CuSO4��Һ��ͨ�백����������������ɫ�������������ܽ�õ�����ɫ��Һ������Һ�д��ڵ������ӵĽṹʽΪ___________________��
��4������NH3����좣�PH3����������������̬�⻯�����Ƿֱ�Ϊ107���93.6�㣬�Է���PH3�ļ���С��NH3��ԭ��__________________________________________________��
��5����VA����̬�⻯��е�����ͼ��ʾ���Խ��ͷе�PH33��PH333��ԭ��____________________________________________________________________��

��6���������Ǿ�����ҪӦ�ü�ֵ�İ뵼�壬�䲿�־���ṹ����ͼ��ʾ��ÿ��������Gaԭ�Ӹ���Ϊ____�����������ױ߳�Ϊa nm����Ϊc nm�����صľ����ܶ�Ϊ___________g/cm3
���ú�a��c�Ĵ���ʽ��ʾ�������ӵ�������NA��ʾ����

���𰸡� 2s22p3 C��O��N sp3 CH4 ![]() N�ĵ縺��ǿ��P���Գɼ����Ӷ�����������ǿ���ɼ����Ӷ�������ԭ�Ӹ������ɼ����Ӷ�֮������С���ų���������ʹ���Ǹ������PH3�ļ���С��NH3�� NH3���Ӽ������������ӽṹ���ƣ���Է����������������Ӽ�������������ǿ 6
N�ĵ縺��ǿ��P���Գɼ����Ӷ�����������ǿ���ɼ����Ӷ�������ԭ�Ӹ������ɼ����Ӷ�֮������С���ų���������ʹ���Ǹ������PH3�ļ���С��NH3�� NH3���Ӽ������������ӽṹ���ƣ���Է����������������Ӽ�������������ǿ 6 ![]() g/cm3
g/cm3
����������1����Ԫ�صĺ˵����Ϊ7����ԭ���������5�����ӣ����̬��ԭ�ӵļ۲�����Ų�ʽΪ2s22p3��̼��������Ԫ�ؾ�Ϊ�ڶ���������Ԫ�أ���һ������������ƣ�������2p���Ϊ������ṹ������ȶ�����һ����ƫ��������Ԫ�صĵ�һ��������С�����˳��ΪC��O��N��
��2��NH4+�����м۲���Ӷ�=4+![]() =4����������ԭ��ԭ�ӹ��Ϊsp3�ӻ�����VSEPRģ��Ϊ�������壬�������к��в��µ��Ӷԣ�������ռ乹��Ϊ�������壬NH4+�е�����Ϊ��7+4-1=10��ԭ����Ϊ5��CH4�е�����Ϊ��6+4=10��ԭ����Ϊ5����NH4+�ǵȵ����壻
=4����������ԭ��ԭ�ӹ��Ϊsp3�ӻ�����VSEPRģ��Ϊ�������壬�������к��в��µ��Ӷԣ�������ռ乹��Ϊ�������壬NH4+�е�����Ϊ��7+4-1=10��ԭ����Ϊ5��CH4�е�����Ϊ��6+4=10��ԭ����Ϊ5����NH4+�ǵȵ����壻
��3����CuSO4��ˮ��Һ����μ��백ˮ�����ӷ���ʽΪ��Cu2++2NH3H2O=Cu��OH��2��+2H2O�����������۲쵽��Һ������ɫ���ձ�Ϊ����ɫ������[Cu��NH3��4]2+����Ӧ�����ӷ���ʽΪ��Cu��OH��2+4NH3H2O=[Cu��NH3��4]2++2OH-+4H2O��[Cu��NH3��4]2+�ĽṹʽΪ![]() ��
��
��4������NH3����좣�PH3���ǵȵ�����ṹ���ƣ���N�ĵ縺��ǿ��P���Գɼ����Ӷ�����������ǿ���ɼ����Ӷ�������ԭ�Ӹ������ɼ����Ӷ�֮������С���ų���������ʹ���Ǹ������PH3�ļ���С��NH3��
��5����VA����̬�⻯��ṹ���ƣ���Ϊ���Ӿ��壬��Է�������Խ���Ӽ�������Խ�е�Խ�ߣ���NH3���Ӽ�����������е���ߣ�
��6��ÿ��������Gaԭ�Ӹ���Ϊ12��![]() +2��
+2��![]() +3=6��Nԭ��Ϊ6��
+3=6��Nԭ��Ϊ6��![]() +4=6��ÿ�������к���6��GaN��ÿ������������Ϊ
+4=6��ÿ�������к���6��GaN��ÿ������������Ϊ![]() �����������Ϊ
�����������Ϊ![]() a2cnm3=
a2cnm3=![]() a2c��10-21cm3���������ܶ�Ϊ
a2c��10-21cm3���������ܶ�Ϊ![]() ��[
��[![]() a2c��10-21cm3]=
a2c��10-21cm3]=![]() g/cm3��
g/cm3��


 ���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д�
���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д� ����ѵ��ϵ�д�
����ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ����٤����������ֵ������˵������ȷ����
A. lmolNa2O��Na2O2�����������������������3NA
B. ���³�ѹ�£�20gD2O����������������Ϊ10NA
C. 50ml12mol��L-1��������������MnO2����ת�Ƶĵ�����Ϊ0.3 NA
D. �ܱ�������2mol NO��Imol��O2����ַ�Ӧ������ķ�����Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״��ֳ���ľ�������Ƿdz���Ҫ�Ļ���ԭ�ϡ�
��1��CO��H2�ڸ��¡���ѹ�����������·�Ӧ���Ʊ��״��������±�����ػ�ѧ�����ܣ������Ƕ���1mol��ѧ��ʱ��Ҫ���յ����������γ�1mol��ѧ��ʱ�ͷŵ����������ݣ�д��CO��CO�����к���C=O����H2��Ӧ���ɼ״����Ȼ�ѧ����ʽ______��
��ѧ�� | H-H | O-H | C-H | C-O | C=O |
����/KJ��mol-1 | 436 | 463 | 413 | 351 | 1076 |
��2���״��������ȡ��ȩCH3OH��g��![]() HCHO(g)+H2(g),�״���ƽ��ת�������¶ȱ仯��������ͼ��ʾ��
HCHO(g)+H2(g),�״���ƽ��ת�������¶ȱ仯��������ͼ��ʾ��

�������ⷴӦ����H___0������>������<������=����
��600Kʱ��Y��״���V(��)___V(��)������>������<������=�������ж�������_____
��������������˵�������ⷴӦ�Ѿ��ﵽƽ��״̬����_____��
A.c��CH3OH��=c��HCHO�� B.HCHO������������ֲ���
C.V����CH3OH��=V�棨HCHO�� D.�������ƽ�����������ֲ���
��3��һ�������£��״���һ����̼��Ӧ���Ժϳ����ᡣ��֪�������£�������ʵĵ���ƽ�ⳣ����Ka��CH3COOH��=1.8��10-5��Ka��HSCN��=0.13��
�����£���20mL0.10mol��L-1CH3COOH��Һ��20mL0.10mol��L-1HSCN��Һ�ֱ���20mL0.10mol��L-1NaHCO3��Һ��ϣ�ʵ���ò���CO2�������V��ʱ��t�仯��ʾ��ͼ����ͼ��ʾ��

�ٷ�Ӧ��ʼ�Σ�������Һ����CO2��������ʴ������Բ����ԭ����_______����Ӧ��������������Һ�У�C��CH3COO-��____ c��SCN-��������>������<������=������
�ڳ��������£���amol��L-1��CH3COOH��bmol��L-1Ba��OH��2��Һ�������ϣ���Ӧƽ��ʱ��2c��Ba2+��=c��CH3COO-��,�ú�a��b�Ĵ���ʽ��ʾ�û����Һ�д���ĵ��볣��Ϊ_______��
��4���״�ȼ�ϵ�ؿ��ܳ�Ϊδ����Я���Ӳ�ƷӦ�õ�������ij�ּ״�ȼ�ϵ�ع���ԭ����ͼ��ʾ����ͨ��a����缫�ĵ缫��ӦʽΪ___________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴ӦN2+3H2![]() 2NH3�ǹ�ҵ�Ϻϳɰ�����Ҫ��Ӧ��
2NH3�ǹ�ҵ�Ϻϳɰ�����Ҫ��Ӧ��

��1������ͼ1��д���ϳɰ����Ȼ�ѧ����ʽ_________________��������E1��E2��E3��ʾ����
��2��ͼ1�����߲�����ͨ���ı仯ѧ��Ӧ�е�________�������������ĸı���ͼ2����һʱ�������ĸı���ͬ___________���á�t1����t6����ʾ����
��3��t3ʱ�̸ı��������___________��t5ʱ�̸ı��������___________��
��4��ij�¶��£�����10 mol N2��30 molH2�������Ϊ10 L���ܱ������ڣ���Ӧ�ﵽƽ��״̬ʱ����û�������а����������Ϊ20%��������ת����____________��
��5����ͬ�¶��£��к����ܱ�����A�ͺ�ѹ�ܱ�����B���������о�����1 molN2��3 molH2����ʱ�������������ȡ���һ�������·�Ӧ�ﵽƽ��״̬��A��NH3���������Ϊa���ų�����Q1kJ��B��NH3���������Ϊb���ų�����Q2kJ����a__________b �����������������=������ͬ����Q1___________Q2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������пƬ�ʹ�ͭƬ��ͼʾ��ʽ����ͬŨ�ȵ�ϡ������һ��ʱ��������������ȷ���� (����)

A. ���ձ�����Һ��pH������
B. ����ͭƬ������������ͭƬ�Ǹ���
C. ���ձ���ͭƬ����������ݲ���
D. �������ݵ��ٶȼױ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij��Һ�м��뺬Fe2������Һ�������Ա仯�����ٵ���������ˮ�����Һ��ɺ�ɫ�������н��۴������(����)
A. ����Һ��һ������SCN�� B. �����ԣ�Fe3����Cl2
C. Fe2����SCN�������γɺ�ɫ���� D. Fe2��������ΪFe3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(Ga)����λ��ͬһ���壬�����ص��۵���29. 8�棬�е���2403�棬��һ�ֹ㷺���ڵ��ӹ�ҵ��ͨѶ�������Ҫ������
(1)��ҵ����������NH3��1000������ºϳɹ���뵼����ϵ����أ�GaN)��ͬʱ����������ÿ����lmol H2ʱ�ų�10.27 kJ������
д���÷�Ӧ.���Ȼ�ѧ����ʽ___________________��
(2)���ܱ������У�����һ������Ga��NH3������Ӧ��ʵ���÷�Ӧƽ����ϵ��NH3�����������ѹǿP���¶�T�Ĺ�ϵ������ͼ1��ʾ��

��ͼ1��A���C�㻯ѧƽ�ⳣ���Ĵ�С��ϵ�ǣ�KA_____ KC��(�<����=����>��)��������____________��
����T1��P6�����·�Ӧ��3minʱ�ﵽƽ�⣬��ʱ�ı���������D�㴦���´ﵽƽ�⣬H2��Ũ���淴Ӧʱ��ı仯������ͼ2��ʾ(34 min��Ũ�ȱ仯δ��ʾ����������ı������Ϊ________(���ı��¶Ȼ�ѹǿ�е�һ�֣���
(3)����ƽ��������ݵ�ƽ���ѹ��PB)�������ʵ���Ũ��(cB)Ҳ���Ա�ʾƽ�ⳣ��(����Kp)���ú�P6��ʽ�ӱ�ʾB���Kp=_____________��
(4)��⾫�����ᴿ�ľ���ԭ�����£��Դ��أ���Zn��Fe��Cu���ʣ�Ϊ�������Ըߴ���Ϊ��������NaOH��ҺΪ����ʣ��ڵ���������ʹ�����ܽ����������Һ����ͨ��ij������Ǩ�Ƽ��������������������ŵ������ߴ��ء�
����֪����������˳��Ϊ��Zn2+3+2+2+����⾫����ʱ������ijɷ���________________��
�����������ܽ����ɵ�Ga3+��.NaOH��Һ��Ӧ����GaO2-���÷�Ӧ�����ӷ���ʽΪ_________________��
GaO2-�������ŵ�ĵ缫��Ӧʽ��________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ�¶Ⱥ�ѹǿ��ƽ��״̬�¿��淴Ӧ2M(g)��N(g)![]() 2Q(g)��H��0��Ӱ�졣�����й�˵����ȷ����(��Ӧ�������������)
2Q(g)��H��0��Ӱ�졣�����й�˵����ȷ����(��Ӧ�������������)
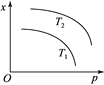
A. x���ܱ�ʾ�÷�Ӧ��ƽ�ⳣ��
B. x���ܱ�ʾƽ��������ܶ�
C. ��x��ʾQ���������ʱ��T2��T1
D. ��x��ʾƽ����������ʵ���ʱ��T2��T1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ѧ��ѧʵ���ҵij���ҩƷ���ش�����ʵ�����⡣
��.����һ�����ʵ���Ũ�ȵ�������Һ��
(1)ij��ʵ���Լ��Ҫ1mol/L������Һ435ml��ͬѧ�Ƿ���ʵ������û��450ml������ƿ��ijͬѧ������1��200ml����ƿ��1��250ml����ƿ�����ƣ�����Ϊ������_________(����������������������)��
(2)ʵ����Ҫ����0.5mol/L H2SO4��Һ250ml��������ȡ�ܶ�Ϊ1.84g/ml��98%��Ũ����________ml��
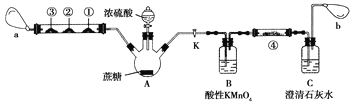
��.������Ũ�����̿��ʵ�������������д̼�����ζ�����壬��Ի��������Ⱦ��ijʵ��С����������װ�öԸ�ʵ����иĽ����ش��������⣺
ע��Ӳ�ʲ������Т��������۴��ֱ�Ϊ����Na2S��Һ����ֽ������Ʒ����Һ����ֽ����������KMnO4��Һ����ֽ��a��b�ֱ�Ϊ����С����
(1)ͼ��ʢװŨ�������������Ϊ________________��
(2)ʵ�鿪ʼ���ȹرջ���K��Ӳ�ʲ������Тٺ���ֽ��ƣ��ںź͢ۺ���ֽ����ɫ��a��������Ӳ�ʲ�������ʵ������˵��̿��ʵ������Ĵ̼�����ζ������SO2�����������۴������ı仯�ֱ�˵��SO2����_____________��_____________��_____________(��SO2���ֳ�������)��
(3)����K��a�������С��b��������ʹ������ƿ�����建��ͨ��Bƿ��Cƿ��һ��ʱ��֮���ֳ���ʯ��ˮ����ǡ�Ϊ֤����CO2���ɣ������ڢܺ�λ�õ���ֽ�μ�______________��Һ�����Լ���������_________________________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com