
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下: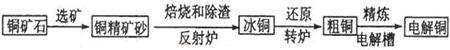
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,两种低价硫化物的化学式分别为________、_______。在反应过程中还有一部分Fe的硫化物转化为低价氧化物,其化学反应方程式为____________。
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量较低。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,,每有1mol氧气参加反应,生成氧化产物的物质的量为_________。生成的Cu2O与Cu2S反应,可制得含Cu量较高的粗铜。
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,c为粗铜板, 则a端应连接电源的_____极(填“正”或“负”),若粗铜中含有Au、Ag、Fe杂质,则电解过程中c电极上发生反应的方程式有__________。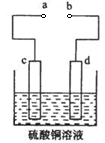
(4)可以应用酸性高锰酸钾溶液滴定法测定反应后电解液中铁元素的含量。滴定时不能用碱式滴定管盛放酸性高锰酸钾溶液的原因是____________,发生反应的离子方程式为_____________,滴定时,锥形瓶中的溶液会接触空气,测得铁元素的含量会____(填“偏高”或“偏低”)。
(1)Cu2S、FeS(每空1分);2FeS+3O2 2FeO+2SO2(缺少条件的扣1分)
2FeO+2SO2(缺少条件的扣1分)
(2)2/3mol(3分,没有单位或单位错误扣1分)
(3)正(1分),Fe-2e-=Fe2+;Cu-2e-=Cu2+(4分,每个方程式2分)
(4)酸性高锰酸钾有强氧化性,能腐蚀碱式滴定管上的橡皮管(或易使橡皮管老化),所以不能用碱式滴定管盛酸性高锰酸钾溶液(必须答出两个要点:一是氧化性;二是橡皮管。缺少一个要点不得分)。
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;偏低。
解析试题分析:(1)Cu的低价为+1价,Fe的低价为+2价,所以两种低价硫化物的化学式分别为Cu2S、FeS;Fe的硫化物转化为低价氧化物,FeS与O2反应生成FeO和SO2,配平可得化学方程式:2FeS+3O2 2FeO+2SO2。
2FeO+2SO2。
(2)Cu2S被氧化为Cu2O的反应方程式为:2Cu2S+3O2 2Cu2O+2SO2,根据化学方程式可得生成的氧化产物为SO2,物质的量为2/3mol。
2Cu2O+2SO2,根据化学方程式可得生成的氧化产物为SO2,物质的量为2/3mol。
(3)c为粗铜板,为阳极,则a端应连接电源的正极;Fe的活泼性大于Cu,所以阳极即c电极Fe和Cu失电子,发生反应的方程式为:Fe-2e-=Fe2+;Cu-2e-=Cu2+。
(4)碱式滴定管含有橡皮管,易被强氧化剂氧化而老化,酸性高锰酸钾具有强氧化性,所以不能用碱式滴定管盛酸性高锰酸钾溶液;MnO4?在酸性条件下把Fe2+氧化为Fe3+,MnO4?被还原为Mn2+,根据化合价升降法配平可得离子方程式:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;滴定时,锥形瓶中的溶液会接触空气,空气中的O2能氧化Fe2+,所以酸性高锰酸钾溶液用量减少,测得铁元素的含量会偏低。
考点:本题考查化学方程式、离子方程式的书写、氧化还原反应原理、电解原理、误差分析。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
(17分)H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛。
(1)某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30% H2O2、0.1mol?L-1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器
①写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:____________
②设计实验方案:在不同H2O2浓度下,测定 ____________________________________(要求所测得的数据能直接体现反应速率大小)。
③设计实验装置,完成下图的装置示意图。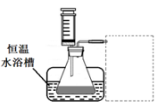
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示)。
(2)利用图21(a)和21(b)中的信息,按图21(c)装置(连能的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是______________________________________________________。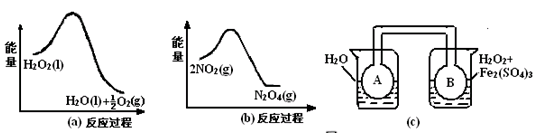
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
化学知识在各个领域应用广泛。如:
(1)2003年10月15日,我国成为世界上第三个将人送入太空的国家,这次载人航天发射使用
的“长征”二号火箭使用偏二甲肼(C2H8N2)作燃料,四氧化二氮为氧化剂,燃烧主要产生CO2、N2等气体,放出的巨大能量把火箭送入太空。反应的化学方程式为: 。(2分)
(2)管道工人曾经用浓氨水检验氯气管道。如果氯气管道某处漏气,会出现白烟现象。氨与氯
气反应的化学方程式为: 。(2分)出现白烟现象的化学方程式为: 。(2分)
(3)二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂。工业生产ClO2过程是将食盐
水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。反应的化学方程式为: 。(2分)
(4)赏心悦目的雕花玻璃是用氢氟酸对玻璃进行刻蚀而制成的。这一过程中发生反应的化学方
程式为: 。(2分)
(5)维生素C在人体内有重要的功能。例如,能帮助人体将食物中摄取的、不易吸收的Fe3+转变为易吸收的Fe2+。这说明维生素C具有 。(填“氧化性”或“还原性”)(2分)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一个氧化还原反应的体系,共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)该反应中,化合价升高的反应物是________,化合价没有发生变化的反应物是________。
(2)写出一个包含上述七种物质的氧化还原反应方程式(需配平)
__________ _____________________________________________________________。
(3)上述反应中,氧化剂是________,1 mol氧化剂在反应中________(填“得到”或“失去”)________ mol电子。
(4)如果在反应后的溶液中加入NaBiO3,溶液又显紫红色。说出NaBiO3的一个性质:
____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某学生往一支试管里按一定次序分别加入下列几种物质:
| A.KI溶液, | B.淀粉溶液, | C.NaOH溶液, | D.氯水。发现溶液颜色按下面次序变化: |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO+4H++3e-=NO↑+2H2O;KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:__________________________________。
(2)反应中硝酸体现了______________、______________的性质。
(3)反应中若产生0.2 mol气体,则转移的电子的物质的量是________ mol。
(4)若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是________________________________________________________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1∶1,写出Se和浓HNO3的反应方程式___________________________________________。
(2)已知:Se+2H2SO4(浓)―→2SO2↑+SeO2+2H2O,2SO2+SeO2+2H2O―→Se+2SO42—+4H+,则SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是______________。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:①SeO2+KI+HNO3―→Se+I2+KNO3+H2O
②I2+2Na2S2O3―→Na2S4O6+2NaI。配平方程式①,标出电子转移的方向和数目。
(4)实验中,准确称量SeO2样品0.150 0 g,消耗了0.200 0 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
过氧化氢(H2O2)是一种无色黏稠液体,它的水溶液俗称双氧水,呈弱酸性,常用作无公害的消毒杀菌剂和漂白剂等。
(1)下列说法正确的是 。
| A.过氧化氢分子中既有极性键又有非极性键 |
| B.H2O2与H2O互为同素异形体 |
| C.34 g H2O2中含有的阴离子数为NA |
| D.实验室可以利用过氧化氢制取氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
利用化合价和物质类别推测物质的性质是化学研究的重要手段。
(1)从化合价的角度可以预测物质的性质。
①SO2的性质___________(填序号,下同);
A.只有氧化性 B.只有还原性 C.既有氧化性又有还原性
②将SO2通入酸性KMnO4溶液中,溶液由紫色褪至无色。反应结束后,硫元素存在形式合理的是__________。
A.S2— B.S C.SO32— D.SO42—
(2)从物质分类的角度可以推测物质的性质。现有由MgO、Al2O3、Fe2O3、SiO2组成的某混合物试样。
①其中Al2O3属于_______氧化物,MgO和Fe2O3属于_________氧化物(填“酸性”、“碱性”或“两性”);
②将试样溶于过量的盐酸中,过滤,滤渣的主要成分是_________;再向滤液中加入NaOH溶液至过量,过滤,滤渣中的主要成分是_________;
③若将该试样直接溶于过量的NaOH溶液中,所发生的反应的化学方程式是______________________(可任意写其中一个)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com