
| A. | 苯 | B. | 苯乙烯 | C. | 乙醇 | D. | 1-己炔 |
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
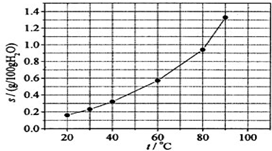
| A. | 温度升高时溴酸银溶解速度加快 | |
| B. | 若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 | |
| C. | 60℃时溴酸银的Ksp约等于6×10-4 | |
| D. | 溴酸银的溶解是放热过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
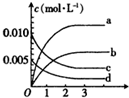 在2L密闭容器内,80℃时反应:2NO(g)+O2(g)?2NO2(g),反应体系中,n(NO)随时间t的变化如表
在2L密闭容器内,80℃时反应:2NO(g)+O2(g)?2NO2(g),反应体系中,n(NO)随时间t的变化如表| 时间t(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5KJ•mol-1(燃烧热) | |
| B. | C2H5OH+3O2═2CO2+3H2O△H=-1368.8KJ•mol-1(反应热) | |
| C. | 2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O (l)△H=-114.6KJ•mol-1(中和热) | |
| D. | 2H2O(g)═2H2(g)+O2(g)△H=+483.6KJ•mol-1(反应热) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属元素单质的熔点随核电荷数增大而升高 | |
| B. | 同一周期元素的原子,半径越小越容易失去电子 | |
| C. | 第ⅥA族元素的氢化物相对分子质量越大,沸点越高 | |
| D. | 卤族元素的原子序数越大,其单质的沸点一定越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z的分解速率和Y的生成速率相等 | |
| B. | 单位时间内生成nmolZ,同时生成nmolX | |
| C. | 反应体系的总质量保持不变 | |
| D. | X、Y、Z的浓度不再变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com