
将锌、铁、铜粉末按一定比例混合投入到一定量的硝酸中,微热,充分反应后过滤,弃去滤渣,滤液中金属阳离子情况不可能是( )
A.只含Cu2+、Fe2+、Zn2+ B.只含Zn2+
C.只含Fe2+、Zn2+ D.只含Cu2+、Fe3+、Zn2+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015届浙江省高三上学期期中联考化学试卷(解析版) 题型:选择题
室温下,0.1mol/L氨水10 mL,加蒸馏水稀释到1 L后,下列变化中正确的是
①电离度增大 ②C(OH-)增大 ③C(H+)增大 ④KW增大 ⑤导电性增强 ⑥C(OH-)/C(NH3 ·H2O)增大
A.①②③ B.①③⑤ C.①③⑥ D.②④⑥
查看答案和解析>>
科目:高中化学 来源:2015届河南郑州市高三上第一次(10月)月考化学试卷(解析版) 题型:选择题
在下列各溶液中离子一定能大量共存的是( )
A.强碱性溶液中:K+、Al3+、 Cl-、SO42-
B.含0.1mol/L Fe3+的溶液中:K+ 、Mg2+ 、I-、NO3-
C.含0.1mol/L Ca2+的溶液中:Na+、K+ 、CO32- 、Cl-
D.室温下pH=1的溶液中:Na+、Fe3+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源:2015届河南省10月联考化学试卷(解析版) 题型:填空题
(14分) 一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的离子反应方程式为(产物中只有一种酸根) 。请从反应原理分析不用盐酸酸化的主要原因____________________________________。
(3)碳酸钠溶液在过程III和IV中所起作用有所不同,请分别用离子方程式表示在过程III、IV中起的作用:__________________________________;____________________________。
(4)某天然碱的化学式可表示为2Na2CO3·NaHCO3·2H2O,取少量该物质溶于水得稀溶液P。下列有关溶液P中微粒的物质的量浓度关系正确的是______(填序号)。
A.c(CO32-) > c(HCO3-)> c(OH-)> c(H+)
B.c(OH-)=c(H+)+ c(HCO3-)+2c(H2CO3)
C.3c(Na+)>5c(CO32-)+5c(HCO3-)
D.将P溶液与少量NaOH溶液混合:c(Na+)+ c(H+)= c(HCO3-)+ 2c(CO32-)+ c(OH-)
(5)CoO溶于盐酸可得粉红色的CoCl2溶液。CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。下图是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,A物质的化学式是_______________。

查看答案和解析>>
科目:高中化学 来源:2015届河南省10月联考化学试卷(解析版) 题型:选择题
正丁醛经催化加氢可制备1-丁醇。为提纯含少量正丁醛杂质的1-丁醇,现设计如下路线:

已知:①正丁醛与饱和NaHSO3溶液反应可生成沉淀;②乙醚的沸点是34℃,难溶于水,与1-丁醇互溶;③1-丁醇的沸点是118℃。则操作1~4分别是( )
A.萃取、过滤、蒸馏、蒸馏 B.过滤、分液、蒸馏、萃取
C.过滤、蒸馏、过滤、蒸馏 D.过滤、分液、过滤、蒸馏
查看答案和解析>>
科目:高中化学 来源:2015届河南省洛阳市高三上学期期中考试化学试卷(解析版) 题型:填空题
有难溶于水的粉末状固体样品,可能含有Al、Fe2O3、Cu2O、SiO2、Fe3O4中的一种或几种,研究小组通过实验确定样品的成分.
【查阅资料知】① Cu2O + 2H+ = Cu + Cu2+ + H2O;
② 部分氢氧化物在溶液中沉淀的pH见下表:
物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 1.8 | 6.3 | 5.2 |
完全沉淀的pH | 3.0 | 8.3 | 6.7 |
【注】金属离子的起始浓度为0.1 mol·L-1
【实验步骤】
Ⅰ.取一定量样品于烧杯中,加足量NaOH溶液,有气体产生,过滤得固体A和无色溶液B;
Ⅱ.向B中加入稀硫酸,出现白色沉淀,继续滴加稀硫酸至过量,白色沉淀完全溶解;
Ⅲ.向A中加入足量稀硫酸并微热,固体完全溶解,得溶液C;
Ⅳ.向C中加入NaClO,调节溶液的pH至4~5,产生红褐色沉淀,过滤得到蓝绿色溶液D;
Ⅴ.向D中加入NaOH,调节溶液的pH到7~8,产生蓝色絮状沉淀.
请回答下列问题.
(1)Ⅰ中产生气体的离子方程式为 .
(2)由Ⅰ、Ⅱ知,原样品中一定不存在的物质是 .
(3)溶液C中除H+、Cu2+外一定还含有的阳离子是 .
(4)Ⅳ中加NaClO的目的是 .
(5)将Ⅳ中得到的溶液D电解,阳极的电极反应式为 ;若电路中有0.1mol电子通过,则理论上阴极质量增重 g.
(6)由上述实验可以获得结论:原样品所有可能的成分组合为组合为
(用化学式表示).
查看答案和解析>>
科目:高中化学 来源:2015届河南省洛阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列物质的转化在给定条件下能实现的是
①NaAlO2(aq) AlCl3
AlCl3 Al
Al
②NH3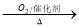 NO
NO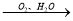 HNO3
HNO3
③NaCl(饱和溶液) NaHCO3
NaHCO3 Na2CO3
Na2CO3
④FeS2 SO3
SO3 H2SO4
H2SO4
A.②③ B.①④ C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源:2015届河南省高三9月第二次阶段考化学试卷(解析版) 题型:填空题
(16分)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙为原料(含量为97.5%A,含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙的主要流程如下:
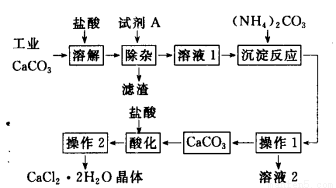
(1)除杂操作时加入试剂A,调节溶液的pH为8.0~8.5,以除去溶液中少量的Al3+、Fe3+。试剂A可以选择 ________________________________。
a.Ca(OH)2 b.NaOH c.NH3 d.Na2CO3
(2)检验溶液1中是否含Fe3+的方法是____________________________
(3)请指出下列操作的名称:操作1_______;操作2___________;请指出操作1中所用的玻璃仪器的名称_____________________。
(4)写出加入碳酸铵所发生的反应的离子方程式_____________;写出溶液2的一种用途_________。
(5)准确称取100 g工业碳酸钙粉末,通过上述方法理论上可以制得质量分数为99%的医药级二水合氯化钙的质量为____________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三上学期第四次检测化学试卷(解析版) 题型:选择题
下列关于电解质溶液的叙述正确的是
A.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Clˉ)>c(NH4+)>c(H+)=c(OHˉ)
B.在0.1mol·L-1 的NaHA溶液pH=4,则H2A为强酸
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊呈红色
D.向0.1mol·L-1的氨水中加少量硫酸铵固体,则溶液中c(OH-)/c(NH3·H2O)增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com