
| 16.8L |
| 22.4L/mol |
| 16.8L |
| 22.4L/mol |
| 1.00mol |
| 2 |
| 1.00mol |
| 2 |


科目:高中化学 来源: 题型:
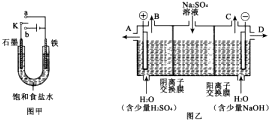 (1)某课外活动小组同学用图甲装置进行实验,试答下列问题:
(1)某课外活动小组同学用图甲装置进行实验,试答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、②③④ |
| C、①②④ | D、①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1120 | B、2240 |
| C、560 | D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、n(NO2-)+n(OH-)-n(H+)=0.1 mol |
| B、若通入0.01 mol HCl气体,溶液pH大于2(忽略溶液体积的变化) |
| C、若加入少量CH3COONa固体,溶液的碱性会减弱 |
| D、此时溶液的pH大于0.1 mol/L的CH3COONa溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A-B | A=B | A≡B | |
| C≡O | 357.7 | 798.9 | 1071.9 |
| N≡N | 154.8 | 418.4 | 941.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com