
| A. | 热稳定性:Na2CO3<NaHCO3 | |
| B. | 相同温度下在水中的溶解度:Na2CO3<NaHCO3 | |
| C. | 取1 mol•L-1的两种溶液,分别滴加澄清石灰水,有沉淀生成的是Na2CO3溶液 | |
| D. | 取等质量的两种固体分别与等浓度等体积的盐酸反应,生成气泡较快的是NaHCO3溶液 |
分析 NaHCO3不稳定,溶解度比Na2CO3小,与盐酸反应较Na2CO3剧烈,可与NaOH反应生成Na2CO3,以此解答该题.
解答 解:A.因2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,而碳酸钠加热不分解,故A错误;
B.在饱和Na2CO3溶液中通入过量二氧化碳可生成NaHCO3沉淀,可说明水中的溶解度:Na2CO3>NaHCO3,故B错误;
C.加入澄清的石灰水,Na2CO3溶液和NaHCO3溶液都能生成CaCO3沉淀,故C错误;
D.NaHCO3与盐酸反应只需一步即放出二氧化碳气体:HCO3-+H+=CO2↑+H2O,而Na2CO3要和HCl反应放出二氧化碳气体需两步:CO32-+H+=HCO3-,HCO3-+H+=CO2↑+H2O,故NaHCO3与盐酸反应更剧烈,反应速率更快,故D正确.
故选D.
点评 本题考查碳酸钠与碳酸氢钠的性质,明确发生的化学反应是解答本题的关键,并注意利用稳定性、与酸的反应、水解、与碱的反应来分析解答.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.5Q | B. | Q | C. | 2Q | D. | 5Q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应热的大小与反应物所具有的能量和生成物所具有的能量无关 | |
| B. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 已知H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ•mol-1,则任何酸碱中和的反应热均为57.3 kJ | |
| D. | 已知2C(s)+2O2(g)═2 CO2(g)△H1,2C(s)+O2(g)═2CO(g)△H2;则△H1<△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
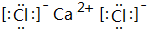
 ;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,该分子的电子式为
;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,该分子的电子式为 ,化学键类型为极性共价键(填“离子键”、“非极性共价键”或“极性共价键”).
,化学键类型为极性共价键(填“离子键”、“非极性共价键”或“极性共价键”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NCl3属于离子晶体 | B. | NCl3中心氮原子为sp2杂化 | ||
| C. | NCl3空间构型为平面三角形 | D. | NCl3分子属于极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com