
| 11.7g |
| 58.5g/mol |
| 14.2g |
| 142g/mol |
| n |
| V |
| 11.7g |
| 58.5g/mol |
| 14.2g |
| 142g/mol |
| n |
| V |
| 0.1mol |
| 0.5L |
| 12g |
| 24g/mol |


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
| A、向Ba(OH)2溶液中滴加NaHSO4至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| B、硫化钠溶液显碱性的原因:S2-+2H2O=H2S+2OH- |
| C、向碳酸钠溶液中通入少量的二氧化硫:2SO2+CO32-+H2O=2HSO3-+CO2↑ |
| D、氯化亚铁溶于稀硝酸中;3FeO+NO3-+10H+=3Fe3++NO↑+5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 分类标准 | 能导电 | 非电解质 | 电解质 |
| 属于该类的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、用锌粒与稀硫酸制取并收集H2 |
| B、用生石灰和浓氨水制取并收集NH3 |
| C、用少量MnO2和H2O2制取并收集O2 |
| D、用浓硫酸和浓盐酸制取并收集HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
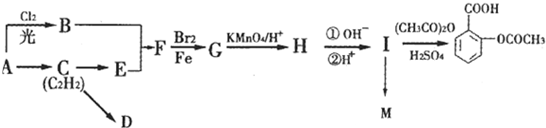
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、称取2.0gNaOH,加入480ml水 |
| B、称取2.0gNaOH,配制480mL溶液 |
| C、称取2.0gNaOH,加入500mL水 |
| D、称取2.0gNaOH,配制500mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
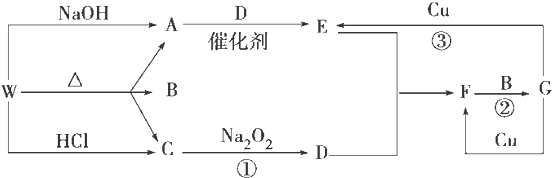
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | 电离平衡常数Ka |
| CH3COOH | Ka=1.76×10-5 |
| H2CO3 | Ka1=4.31×10-7 Ka2=5.61×10-11 |
| H3PO4 | Ka1=7.52×10-3 Ka2=6.23×10-8 Ka3=4.50×10-13 |
| A、温度升高,Ka值减小 |
| B、0.1 mol?L-1 CH3COOH溶液中加入少量冰醋酸,c(H+)/c(CH3COOH)将增大 |
| C、等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(CH3COONa)>pH(Na3PO4) |
| D、PO43-、HPO42-和H2PO4-在溶液中不能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 陈述I | 陈述Ⅱ | |
| A | 常温下铁、铜均不溶于浓硫酸 | 常温下铁、铜与浓硫酸均不反应 |
| B | HCl与Na2CO3溶液反应生成CO2 | 用饱和Na2CO3溶液除去CO2中的少量HCl |
| C | Cl2使润湿的有色布条褪色,而干燥的布条不褪色 | 次氯酸的氧化性比氯气的强 |
| D | 稀、浓HNO3分别与铜反应,还原产物为NO和NO2 | 稀HNO3氧化性比浓HNO3强 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com