
| A. | ① | B. | ②③④ | C. | ①②④ | D. | ①②⑤ |
分析 对于反应3Fe(s)+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2(g)来说,增大压强、浓度、升高温度以及增大固体的表面积,都可增大反应速率,以此解答.
解答 解:①Fe为固体,增加铁的量,反应速率不变,故选;
②恒压下增加水的用量,应使体积增大,则水的浓度增大,氢气的浓度减小,反应速率改变,故不选;
③用铁粉代替铁屑,固体表面积增大,反应速率增大,故不选;
④升温,反应速率增大,故不选;
⑤压强不变,充入N2使容器体积增大,浓度减小,反应速率减小,故不选.
故选A.
点评 本题考查化学反应速率,为高频考点,侧重于学生的分析能力和基本理论、概念的综合理解和运用的考查,难度不大,注意相关基础知识的积累,注意压强与浓度的关系.


科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| CO | H2 | CH3OH |
| 0.5mol•L-1 | 2mol•L-1 | 6mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质的水溶液中不存在分子 | |
| B. | 纯水和干木头都不导电,但木头用水浸湿后却可以导电 | |
| C. | 某溶液的PH=7,该溶液一定呈中性 | |
| D. | 不溶性盐都是弱电解质,可溶性酸和强碱都是强电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
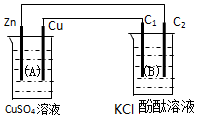 按如图装置进行实验,图中C1、C2均为石墨棒.请回答下列问题.
按如图装置进行实验,图中C1、C2均为石墨棒.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | 化学变化 | 物理变化 |
| B | 氧化还原反应 | 分解反应 |
| C | 氧化还原反应 | 化合反应 |
| D | 中和反应 | 复分解反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{2}$N2H4(g)+$\frac{1}{2}$O2(g)═$\frac{1}{2}$N2(g)+H2O(g)△H=+267kJ/mol | |
| B. | N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=-534kJ/mol | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=+534kJ/mol | |
| D. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
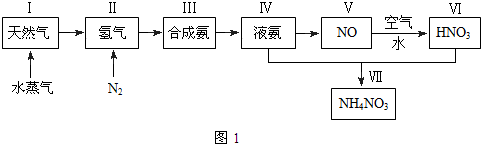
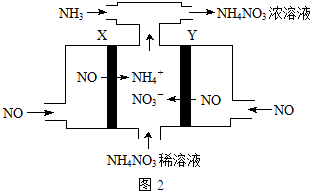
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com