
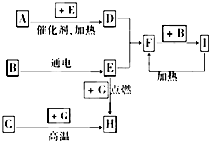
 下列是中学化学中常见物质间的反应转化关系图,其中部分产物已略去,常温下,G为固体单质,B、I为液体,其余都为气体.A为化合物,I的浓溶液与G在加热条件下生成F、B和C. H可用作工业上冶炼金属的还原剂.请按要求填空:
下列是中学化学中常见物质间的反应转化关系图,其中部分产物已略去,常温下,G为固体单质,B、I为液体,其余都为气体.A为化合物,I的浓溶液与G在加热条件下生成F、B和C. H可用作工业上冶炼金属的还原剂.请按要求填空:分析 气体H可用作工业冶炼金属的还原剂,推断H为CO,所以G为碳,C为CO2,E与G点燃得到H,则E为O2,液体B电解得到氧气,故B为H2O,G和I浓溶液反应得到水、气体F与C,而F与水反应又得到I,则I为HNO3,F为NO2,可推知D为NO,A为NH3,验证符合转化关系,据此解答.
解答 解:气体H可用作工业冶炼金属的还原剂,推断H为CO,所以G为碳,C为CO2,E与G点燃得到H,则E为O2,液体B电解得到氧气,故B为H2O,G和I浓溶液反应得到水、气体F与C,而F与水反应又得到I,则I为HNO3,F为NO2,可推知D为NO,A为NH3,验证符合转化关系,
(1)由上述分析可知,A为NH3,B为H2O,C为CO2,
故答案为:NH3;H2O;CO2;
(2)F+B→I的反应是二氧化氮与水的反应,反应的化学方程式为3NO2+H2O=2HNO3+NO↑,
故答案为:3NO2+H2O=2HNO3+NO↑;
(3)G和I的浓溶液反应是碳单质和浓硝酸加热反应生成二氧化碳、二氧化氮和水,反应的化学方程式为:C+4HNO3(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2H2O+4NO2↑,
故答案为:C+4HNO3(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2H2O+4NO2↑.
点评 本题考查无机物推断,H可用作工业冶炼金属的还原剂、物质的状态、转化中特殊反应等是推断突破口,需要学生熟练掌握元素化合物性质,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | CO2和SiO2 | B. | Na和I2 | C. | 蔗糖和干冰 | D. | 金刚石和石墨 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
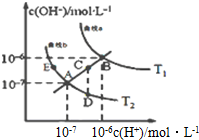 水的电离常数如图两条曲线所示,曲线中的点都符合c(H+)×c(OH-)=常数,下列说法错误的是( )
水的电离常数如图两条曲线所示,曲线中的点都符合c(H+)×c(OH-)=常数,下列说法错误的是( )| A. | 图中温度T1>T2 | |
| B. | 图中五点Kw间的关系:B>C>A=D=E | |
| C. | 曲线a、b可以表示纯水的电离情况 | |
| D. | 若处在B点时,将pH=2的硫酸溶液与pH=11的KOH溶液等体积混合后,溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解得到的汽油是纯净物 | |
| B. | 煤的气化是物理变化 | |
| C. | 天然气是一种清洁的化石燃料 | |
| D. | 水煤气是通过煤的液化得到的气体燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 2.0 | 1.0 | 0.8 | 0.7 | 0.7 | 0.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2 (g)?CH3OH (g)△H=-116kJ/mol
工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2 (g)?CH3OH (g)△H=-116kJ/mol查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com