
| 实验操作及现象 | 实验结论 | |
| A | 分别向2mL 0.1mol•L-1 CH3COOH溶液和2mL 0.1mol•L-1 H3BO3溶液中滴加等浓度的NaHCO3溶液,前者有气泡产生,后者无明显现象 | 酸性:CH3COOH>H2CO3>H3BO3 |
| B | 向2mL 0.1mol•L-1 NaOH溶液中滴加3滴0.1mol•L-1 MgCl2溶液,出现白色沉淀后,再滴加3滴0.1mol•L-1 FeCl3溶液,出现红褐色沉淀 | 溶解度:Mg(OH)2>Fe(OH)3 |
| C | 过氧化钠用于呼吸面具中作为氧气的来源 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
| D | 向含有淀粉的FeI2溶液中滴加足量的氯水后变蓝 | 还原性:I->Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.发生强酸制取弱酸的反应;
B.NaOH溶液过量,发生沉淀的生成,无法判断氢氧化镁与氢氧化铁的溶解度大小;
C.过氧化钠与二氧化碳的反应中,过氧化钠既是氧化剂又是还原剂;
D.氯水足量,亚铁离子和碘离子都参与反应.
解答 解:A.2mL 0.1mol•L-1 CH3COOH溶液中滴加等浓度的NaHCO3溶液,有气泡产生,发生强酸制取弱酸的反应,则酸性为CH3COOH>H2CO3,故A正确;
B.向2mL 0.1mol•L-1 NaOH溶液中滴加3滴0.1mol•L-1 MgCl2溶液,NaOH溶液过量,发生沉淀的生成,而不发生沉淀的转化,则不能比较溶度积大小,故B错误;
C.过氧化钠与二氧化碳反应生成碳酸钠和氧气,故过氧化钠用于呼吸面具中作为氧气的来源,但是该反应中二氧化碳既不是氧化剂也不是还原剂,故C错误;
D.向含有淀粉的FeI2溶液中滴加足量的氯水,I-、Fe2+都参与反应,无法比较二者还原性,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及酸性比较、沉淀的生成及转化、电解质判断、影响反应速率的因素等,侧重化学反应原理及实验分析能力的考查,注意实验的评价性、操作性分析,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 利用催化设施,可以将汽车尾气中CO和NO转化为无害气体 | |
| B. | 锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去 | |
| C. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| D. | 防止酸雨发生的重要措施之一是使用清洁能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,20mL NH3跟60mL O2所含的分子个数比为1:3 | |
| B. | 22.4L O2中一定含有6.02×1023个氧分子 | |
| C. | 将80克NaOH溶于1L水中,所得溶液的物质的量浓度为2mol/L | |
| D. | 18克H2O在标准状况下的体积为0.018L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 反应类型取代反应
反应类型取代反应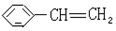 使溴水褪色的反应方程式
使溴水褪色的反应方程式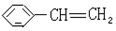 +Br2→
+Br2→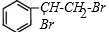 反应类型加成反应
反应类型加成反应 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 2 mol•L-1的NaCl | B. | 75 mL 2 mol•L-1的NH4Cl | ||
| C. | 150 mL 3 mol•L-1的KCl | D. | 75 mL 2 mol•L-1的CaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
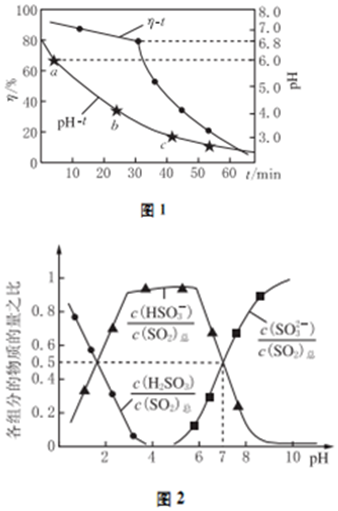
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com