
| 化学式 | 电离常数 |
| HF | Ka=3.5×10-4 |
| H2CO3 | Ka1=4.3×10-7 |
| Ka2=5.6×10-11 | |
| HClO | Ka=3.2×10-8 |
| A. | 同温同浓度下,溶液的pH值:NaF>NaClO>Na2CO3 | |
| B. | 结合H+的能力:ClO->CO32->F- | |
| C. | 碳酸钠溶液中加入少量氢氟酸的离子方程式:CO32-+2HF═2F-+H2O+CO2↑ | |
| D. | 次氯酸钠溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O═HCO3-+HClO |
分析 弱酸的电离平衡常数越大,酸性越强,弱酸的电离平衡常数越小,酸性越弱,其酸根结合氢离子的能力越强,其对应的盐水解程度越大,强酸可以制弱酸.
解答 解:据表格分析,酸性由强到弱的顺序为:HF、H2CO3、HClO,
A、酸性由强到弱的顺序为:HF、H2CO3、HClO,酸性越弱,其酸根水解结合氢离子的能力越强,溶液的碱性越强,所以溶液pH:Na2CO3>NaClO>NaF,故A错误;
B、酸性由强到弱的顺序为:HF、H2CO3、HClO,结合H+ 的能力:CO32->ClO->F-,故B错误;
C、碳酸钠溶液中加入少量氢氟酸时,先生成碳酸氢根离子,离子方程式为:CO32-+HF=F-+HCO3-,故C错误;
D、碳酸的第一步电离酸性比次氯酸强,可以发生反应,ClO-+CO2+H2O=HCO3-+HClO,故D正确;
故选D.
点评 本题考查了据弱酸的电离平衡常数判断酸性强弱及强酸制弱酸,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 2-甲基-2-丁炔 | B. | 1,3,4-三甲苯 | C. | 3-甲基-2-丁烯 | D. | 2-乙基-2-丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| I1/KJ•mol-1 | I2/KJ•mol-1 | I3/KJ•mol-1 | I4/KJ•mol-1 | I5/KJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
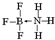 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

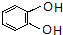 ,C的系统命名是3-溴丙烯(或3-溴-1-丙烯).
,C的系统命名是3-溴丙烯(或3-溴-1-丙烯). (或
(或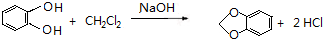 ).
).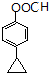 或
或 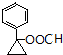 (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
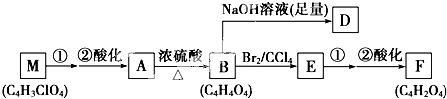
 +(2n-1)H2O.
+(2n-1)H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 金属(粉末) | 物质的量(mol) | 酸的浓度 | 酸的体积 | 反应温度 |
| A | Mg | 0.1 | 6mol/L HNO3 | 10mL | 60℃ |
| B | Mg | 0.1 | 1.5mol/L HCl | 10mL | 60℃ |
| C | Fe | 0.1 | 3mol/L HCl | 10mL | 60℃ |
| D | Mg | 0.1 | 3mol/L HCl | 10mL | 60℃ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HBr分子中的键长比HI分子中的键长短,键能大 | |
| B. | HBr分子中的键长比HI分子中的键长长,键能小 | |
| C. | HBr的相对分子质量比HI的相对分子质量小 | |
| D. | HBr分子间作用力比HI分子间作用力大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤⑥ | B. | ①②④⑤ | C. | ②③⑤⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com