
【题目】取 1LFeCl3 溶液腐蚀铜板制作电路板,反应后在此残留液中慢慢加入铁粉,溶液中 Fe2+的浓度变化如图所示(加入固体引起的体积变化忽略不计),下列说法错误的是
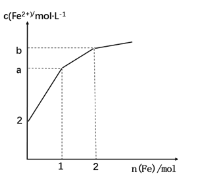
A.当n(Fe)=0.5mol 时,发生的离子反应为 Fe+2Fe3+=3Fe2+
B.当 n(Fe)=1.5mol 时,溶液中发生的总反应离子方程式为4Fe3++Cu2++3Fe=7Fe2++Cu
C.当n(Fe)=1mol 时,溶液中 c(Fe2+)=5 mol·L-1
D.腐蚀之前原溶液中n(Fe3+)=4 mol
【答案】D
【解析】
由于氧化性:Fe3+>Cu2+>H+,加入Fe在0mol到1mol时发生反应:Fe+2Fe3+=3Fe2+,加入Fe在1mol到2mol时发生反应:Fe+Cu2+=Cu+Fe2+,加入Fe大于2mol后发生反应:Fe+2H+=Fe2++H2↑。残留液中c(Fe2+)=2mol/L,残留液中加入1molFe将Fe3+消耗完毕,由Fe~2Fe3+可知,残留液中含有Fe3+为1mol×2=2mol。Cu2+完全反应消耗Fe消耗为2mol-1mol=1mol,由Fe~Cu2+可知残留液中Cu2+为1mol,由Cu+2Fe3+=Cu2++2Fe2+,可知Cu反应消耗为Fe3+为1mol×2=2mol,故原FeCl3溶液中FeCl3为2mol+2mol=4mol。
A.由上述分析可知,当n(Fe)=0.5mol时,发生的离子反应为Fe+2Fe3+=3Fe2+,故A正确;
B.由上述分析可知,当n(Fe)=1.5mol时,其中0.5molFe发生:Fe+Cu2+=Cu+Fe2+,反应的Fe、Fe3+、Cu2+分别为1.5mol、2mol、0.5mol,溶液中发生的总反应离子方程式为:4Fe3++Cu2++3Fe=7Fe2++Cu,故B正确;
C.由上述分析可知,当n(Fe)=1mol时,溶液中c(Fe2+)=![]() =5molL1,故C正确;
=5molL1,故C正确;
D.原FeCl3溶液中FeCl3浓度为![]() =4mol/L,由于Fe3+离子水解,故c(Fe3+)略小于4molL1,故D错误;
=4mol/L,由于Fe3+离子水解,故c(Fe3+)略小于4molL1,故D错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】有机物A、B、C、D和E的结构简式如下:
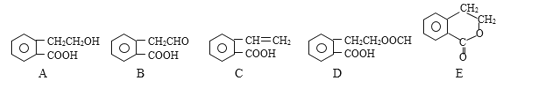
请回答下列问题:
(1)指出反应的类型:A→B_______;A→D_______。
(2)在A~E五种物质中,互为同分异构体的是_______;所有的原子有可能都在同一平面的物质是_______。(填序号)
(3)写出由A生成C的化学方程式:_______。
(4)写出D与NaOH溶液共热反应的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是制备和收集气体的实验装置,该装置不能用于( )
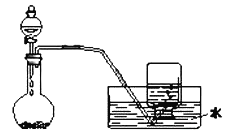
A.Zn与稀硫酸制H2B.稀硝酸与铜反应制取一氧化氮
C.双氧水制取氧气D.用Cu和浓硫酸制取SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的X加入某密闭容器中,发生反应:2X(g)![]() 3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:下列推断正确的是()。
3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:下列推断正确的是()。
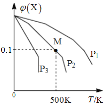
A. 升高温度,该反应平衡常数K减小
B. 压强大小有P3>P2>P1
C. 平衡后加入高效催化剂使平均摩尔质量增大
D. 在该条件下M点X平衡转化率为9/11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于苯乙烯的下列叙述
![]()
①能使酸性KMnO4溶液褪色;②可发生加聚反应;③可溶于水;④可溶于苯中;
⑤苯环能与溴水发生取代反应;⑥所有的原子可能共面,且最多有5个原子共线。其中完全正确的是
A. ①②④B. ①②④⑥C. ①②④⑤⑥D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种废水处理剂可表示为MxFey(SO4)z(OH)w,可按下列实验步骤确定其组成(气体体积在标准状况下测定):
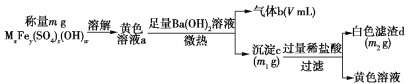
下列有关叙述错误的是
A.检验a中是否含有Fe3+可用KSCN溶液
B.气体b能使湿润的红色石蕊试纸变蓝
C.加入稀盐酸的目的是溶解其中的氢氧化物
D.若V=448,m1=13.6,m2=9.32,可确定该化合物为NH4Fe3(SO4)2(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组同学利用以下装置制备氨气,并探究氨气的性质(部分仪器已略去)。请回答:

(1)实验室制备氨气的化学方程式为__________。
(2)用装置B收集氨气时,应选择氨气的进气口是_____(选填“a”或“b”),并说明选择的理由是___________。
(3)打开装置B中的止水夹c,若观察到圆底烧瓶内产生了红色喷泉,则说明氨气具有的性质是_________,_________。
(4)为防止污染环境,以下装置(盛放的液体均为水)可用于吸收多余氨气的是_____(填序号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二氯丙烷(CH2ClCHClCH3)是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为3-氯丙烯(CH2=CHCH2Cl),反应原理为:
I.CH2=CHCH3(g)+Cl2(g)![]() CH2ClCHClCH3(g) H1=-134kJ·mol1
CH2ClCHClCH3(g) H1=-134kJ·mol1
II.CH2=CHCH3(g)+Cl2(g)![]() CH2=CHCH2Cl(g)+HCl(g) H2=-102kJ·mol1
CH2=CHCH2Cl(g)+HCl(g) H2=-102kJ·mol1
请回答下列问题:
(1)已知CH2=CHCH2Cl(g)+HCl(g)![]() CH2ClCHClCH3(g)的活化能Ea(正)为132kJ·mol1,则该反应的活化能Ea(逆)为___________kJ·mol1。
CH2ClCHClCH3(g)的活化能Ea(正)为132kJ·mol1,则该反应的活化能Ea(逆)为___________kJ·mol1。
(2)一定温度下,密闭容器中发生反应I和反应II,达到平衡后增大压强,CH2ClCHClCH3的产率____________(填“增大”“减小”或“不变”),理由是_____________________________。
(3)起始时向某恒容绝热容器中充入1mol CH2=CHCH3和1mol Cl2发生反应II,达到平衡时,容器内气体压强_________________(填“增大”“减小”或“不变”)。
(4)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g)。在催化剂作用下发生反应I,容器内气体的压强随时间的变化如下表所示。
时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
①用单位时间内气体分压的变化来表示反应速率,即![]() ,则前120min内平均反应速率v(CH2ClCHClCH3)=__________kPa·min1。(保留小数点后2位)。
,则前120min内平均反应速率v(CH2ClCHClCH3)=__________kPa·min1。(保留小数点后2位)。
②该温度下,若平衡时HCl的体积分数为![]() ,则丙烯的平衡总转化率
,则丙烯的平衡总转化率____________;反应I的平衡常数Kp=____________________kPa1(Kp为以分压表示的平衡常数,保留小数点后2位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com