
| A. | 化学反应必然伴随发生能量变化 | |
| B. | 化学反应中的能量变化主要是由化学键变化引起的 | |
| C. | 反应物的总能量与生成物的总能量一定相等 | |
| D. | 化学反应中既有物质变化又有能量变化 |
科目:高中化学 来源: 题型:解答题
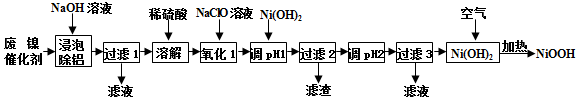
| 开始沉淀的pH | 完全沉淀的pH | |
| Ni2+ | 6.2 | 8.6 |
| Fe2+ | 7.6 | 9.1 |
| Fe3+ | 2.3 | 3.3 |
| Cr3+ | 4.5 | 5.6 |
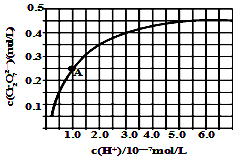
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
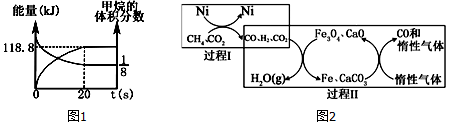
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
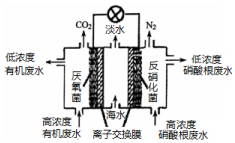
| A. | 该电池能在高温下工作 | |
| B. | 该电池工作时,中间室中的Cl-移向右室 | |
| C. | 正极上发生的电极反应:2NO3-+6H2O+10e-═N2↑+12OH- | |
| D. | 若有机废水中有机物用C6H12O6表示,每消耗1 mol C6H12O6转移4 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
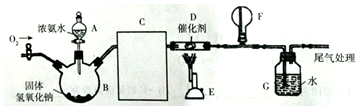
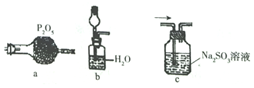
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100℃纯水的pH<7,此时水仍呈中性 | |
| B. | pH=3的醋酸溶液,稀释至100倍后pH小于5 | |
| C. | 0.2 mol/L的盐酸,与等体积水混合后pH=1 | |
| D. | pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.20mol | B. | 0.40mol | C. | 0.42mol | D. | 0.60m |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度升高,反应速率增大,产率增大 | |
| B. | 增大反应物H2的浓度,HI%增大 | |
| C. | 增大压强,浓度增大,平衡不移动 | |
| D. | 使用催化剂,反应速率增大,I2的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
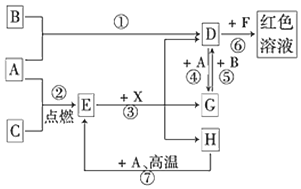
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com