
已知H2(g) + I2(g) ![]() 2HI(g) △H < 0,有相同容积的密封容器甲和乙,甲中加入H2和I2各0.1mol ,乙中加入0.1mol H2和0.2mol I2,相同温度下分别达到平衡。下列说法不正确的是
2HI(g) △H < 0,有相同容积的密封容器甲和乙,甲中加入H2和I2各0.1mol ,乙中加入0.1mol H2和0.2mol I2,相同温度下分别达到平衡。下列说法不正确的是
A.乙中反应速率比甲中反应速率快
B.平衡时甲、乙两容器中混合物的总物质的量之比为2:3
C.若平衡时甲中H2的转化率为40%,则乙中H2的转化率大于40%
D.平衡后,向乙中再加入0.1mol H2,建立新的平衡时,甲和乙中H2的百分含量不相同
科目:高中化学 来源: 题型:
已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为
A.-44.2kJ·mol-1 B.+44.2 kJ·mol-1 C.-330 kJ·mol-1 D.+330 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河北省石家庄市高二上学期期中考试理科化学试卷(解析版) 题型:填空题
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热ΔH分别为-285.8 kJ/mol、-283.0 kJ/mol和-726.5 kJ/mol。请回答下列问题:
(1)用太阳能分解10 mol水消耗的能量是__________kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为________________________;
查看答案和解析>>
科目:高中化学 来源:2014届山西省高二上学期期末联考化学(理)试卷(A)(解析版) 题型:选择题
已知H2(g)+Cl2(g)="2HCl(g)" △H =" ―184.6" kJ·mol-1,下列说法中正确的是
A.该反应为吸热反应
B.H2的能量一定高于HCl
C.反应HCl(g)=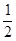 H2(g)+
H2(g)+
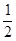 Cl2(g) 的 △H为 +92.3 kJ·mol-1
Cl2(g) 的 △H为 +92.3 kJ·mol-1
D.该反应为放热反应,故不必加热就可发生反应
查看答案和解析>>
科目:高中化学 来源:2013届黑龙江省高二上学期期末考试化学试卷 题型:填空题
(9分)(1)已知25℃、101kPa时,一些物质的燃烧热为:
|
化学式 |
CO(g) |
H2(g) |
CH3OH(l) |
|
ΔH/( kJ·mol-1) |
-283.0 |
-285.8 |
-726.5 |
请回答下列问题:①该条件下CH3OH(l)完全燃烧的热化学方程式为:__________________________。
②根据盖斯定律完成下列反应的热化学方程式:CO(g)+2H2(g)===CH3OH(l)ΔH=____________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
① CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1=+49.0 kJ·mol-1
② CH3OH(g)+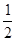 O2(g)=
CO2(g)+2H2(g) △H2
O2(g)=
CO2(g)+2H2(g) △H2
已知H2(g)+ 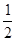 O2(g)===H2O(g)
△H = -241.8 kJ·mol-1
O2(g)===H2O(g)
△H = -241.8 kJ·mol-1
则反应②的△H2 = kJ·mol-1。
(3)甲醇燃料电池的结构示意图如下。甲醇进入 极(填“正”或“负”),正极发生的电极反应为 。
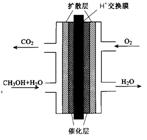
查看答案和解析>>
科目:高中化学 来源:2013届山东济宁鱼台二中高二上学期期末考前模拟化学试卷 题型:填空题
(9分)(1)已知25℃、101kPa时,一些物质的燃烧热为:
|
化学式 |
CO(g) |
H2(g) |
CH3OH(l) |
|
ΔH/( kJ·mol-1) |
-283.0 |
-285.8 |
-726.5 |
请回答下列问题:①该条件下CH3OH(l)完全燃烧的热化学方程式为:__________________________。
②根据盖斯定律完成下列反应的热化学方程式:CO(g)+2H2(g)===CH3OH(l)ΔH=____________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
① CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1=+49.0 kJ·mol-1
② CH3OH(g)+ O2(g)=
CO2(g)+2H2(g) △H2
O2(g)=
CO2(g)+2H2(g) △H2
已知H2(g)+  O2(g)===H2O(g)
△H = -241.8 kJ·mol-1
O2(g)===H2O(g)
△H = -241.8 kJ·mol-1
则反应②的△H2 = kJ·mol-1。
(3)甲醇燃料电池的结构示意图如下。甲醇进入 极(填“正”或“负”),正极发生的电极反应为 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com