
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:解答题
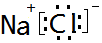 .
.| 化合物 | MgO | MgCl2 |
| 类型 | 离子化合物 | 离子化合物 |
| 熔点/℃ | 2800 | 714 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4F溶液不能存放于玻璃试剂瓶中 | |
| B. | 氮元素的非金属性强于磷,在常温下氮气活泼性也强于磷 | |
| C. | 苯不能使酸性高锰酸钾溶液褪色,所以苯不能发生氧化反应 | |
| D. | 二氧化硫和次氯酸的漂白原理不同,二氧化硫漂白时没有发生化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性:Fe3+>Cu2+>Fe2+>Zn2+ | B. | 还原性:Fe3+>Cu2+>Fe2+>Zn2+ | ||
| C. | 氧化性:Zn>Fe>Cu>Fe2+ | D. | 还原性:Zn>Fe>Cu>Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,B的分子式C7H6O2,C的一种同分异构体的结构简式CH3CH2NO2.
,B的分子式C7H6O2,C的一种同分异构体的结构简式CH3CH2NO2.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C和E的单质常温下不能相互反应 | |
| B. | C与B形成的两种化合物均属于离子化合物,且化学键类型完全相同 | |
| C. | 原子半径:C>D>A>B | |
| D. | A、D、E的最高价氧化物对应水化物均为弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+、Na+、Cl-、K+ | B. | Na+、Fe2+、SO42-、NO3- | ||
| C. | Mg2+、Na+、SO42-、Cl- | D. | Ba2+、HCO3-、NO3-、K+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com