


 $\stackrel{自动}{→}$
$\stackrel{自动}{→}$
 ②
②
分析 根据题中各物质的转化关系,甲烷与氯气发生取代生成A为二氯甲烷,二氯甲烷碱性水解发生信息Ⅲ中的反应生成B为HCHO,B与HCN发生加成再水解、酸化可得HOCH2COOH,HOCH2COOH发生缩聚反应得高分子,甲烷与氯气发生取代生成C为CH3Cl,CH3Cl发生水解得D为CH3OH,氯仿与HF发生取代生成CHClF2,CHClF2加热生成F为CF2=CF2,CF2=CF2发生加聚反应生成聚四氟乙烯,氯仿与氧气反应生成COCl2,COCl2与甲醇发生取代反应生成E,据此答题.
解答 解:根据题中各物质的转化关系,甲烷与氯气发生取代生成A为二氯甲烷,二氯甲烷碱性水解发生信息Ⅲ中的反应生成B为HCHO,B与HCN发生加成再水解、酸化可得HOCH2COOH,HOCH2COOH发生缩聚反应得高分子,甲烷与氯气发生取代生成C为CH3Cl,CH3Cl发生水解得D为CH3OH,氯仿与HF发生取代生成CHClF2,CHClF2加热生成F为CF2=CF2,CF2=CF2发生加聚反应生成聚四氟乙烯,氯仿与氧气反应生成COCl2,COCl2与甲醇发生取代反应生成E,
(1)根据上面的分析可知,反应③的反应类型是取代反应,F为CF2=CF2,F中所含有的官能团名称是氟原子和碳碳双键,
故答案为:取代反应;氟原子和碳碳双键;
(2)根据上面的分析可知,B为HCHO,C为CH3Cl,
故答案为:HCHO;CH3Cl;
(3)反应①为HOCH2COOH的缩聚反应,反应的化学方程式为 ,反应②为COCl2与甲醇发生取代反应生成E,反应的方程式为
,反应②为COCl2与甲醇发生取代反应生成E,反应的方程式为 ,
,
故答案为: ;
; ;
;
(4)A、氯仿在NaOH溶液中加热,充分反应后可生成HCOONa,故A正确;
B、CHFCl2、CHClF2都没有同分异构体,故B错误;
C、CH3OCOOCH3在酸性条件下可水解生成甲醇和CO2,故C正确;
D、B为HCHO,1moI B与足量的银氨溶液混合,水浴加热,充分反应后能生成4molAg,故D错误,
故选:AC.
点评 本题考查有机物的合成,题目难度中等,注意充分 利用题中信息,熟记常见官能团的相互转化条件,灵活运用有机物的性质,对学生的综合能力有一定的要求.


科目:高中化学 来源: 题型:选择题
 硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如图,该电池工作时反应为:4VB2+11O2→4B2O3+2V2O5.下列说法正确的是( )
硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如图,该电池工作时反应为:4VB2+11O2→4B2O3+2V2O5.下列说法正确的是( )| A. | 电极a为电池负极,发生还原反应 | |
| B. | 每消耗1mol VB2转移6mol电子 | |
| C. | 电池工作时,OH-向电极a移动 | |
| D. | VB2极发生的电极反应为:2VB2+22OH--22e-→V2O5+2B2O3+11H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在混合液中加入氢氧化钠溶液,充分振荡后分液 | |
| B. | 在混合液中加人一定量的浓硫酸和乙醇,加热,将乙酸转化为乙酸乙酯 | |
| C. | 在混合液中加人足量的水.充分振荡后分液 | |
| D. | 在混合液中加入适量的饱和碳酸钠溶液,充分振荡后分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.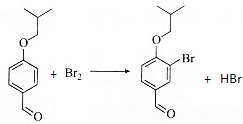 .
. .
.
 +Na2CO3→
+Na2CO3→ +NaHCO3,其目的是保护酚羟基,防止为氧化.
+NaHCO3,其目的是保护酚羟基,防止为氧化.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  |  |  |
| 根据图中a点数据计算N2的平衡体积分数:14.5% | 表示从通入原料开始,随温度不断升高,NH3物质的量变化的曲线示意图 | 向绝热恒容器中通入N2和H2,△t1=△t2时,N2的转化率:a-b段大于b-c段 | 图中T2<T1 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 分子式 | C4H10O | C3H8 | C7H16 | C8H10 |
| 限定条件 | 能与钠反应 | 二氯代物 | 分子中含有3个甲基 | 芳香烃,能得到3中硝化产物 |
| 同分异构体数目 | 4 | 3 | 2 | 3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18O2-结构示意图: | |
| B. | 硝基苯的结构简式: | |
| C. | NaHSO4熔融时电离方程式:NaHSO4═Na++HSO4- | |
| D. | 模型 可表示甲烷分子或四氯化碳分子 可表示甲烷分子或四氯化碳分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com