
 为了分别研究SO2和Cl2的性质,设计了如图1所示的实验装置.
为了分别研究SO2和Cl2的性质,设计了如图1所示的实验装置.分析 (1)二氧化硫具有漂白性,氯气与水反应生成HClO,HClO具有漂白性;二氧化硫和溴化铁发生氧化还原反应,失电子的反应物作还原剂;
(2)通入足量的氯气,碘完全反应,根据转移电子数目计算I元素在氧化产物中的化合价,确定产物,据此书写;
(3)最后一个装置存在安全隐患.
解答 解:(1)二氧化硫具有漂白性,氯气与水反应生成HClO,HClO具有漂白性,故通入二氧化硫与通入氯气,装置A中的品红溶液都褪色;
III中铁离子具有氧化性,能和二氧化硫发生氧化反应生成硫酸和亚铁离子,离子反应方程式为:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+;
该反应中,硫元素失电子化合价升高,所以二氧化硫作还原剂,
故答案为:相同;2Fe3++SO2+2H2O═2Fe2++SO42-+4H+;还原;
(2)装置B中装有5.0mL 1.0mol•L-1的碘水,当通入足量Cl2完全反应后,共转移了5.0×10-2mol电子,故I元素在氧化产物中的化合价为$\frac{5.0×1{0}^{-2}mol}{0.005L×1.0mol/L}$=5,故氧化产物为HIO3,氯气被还原为HCl,反应方程式为:5Cl2+I2+6H2O=10HCl+2HIO3;
故答案为:5Cl2+I2+6H2O=10HCl+2HIO3;
(3)尾气处理装置中,如果气体压强过大,导致塞子冲出而引起安全隐患,其处理方法为:去掉胶塞或将广口瓶的塞子换成双孔塞,另一孔插入一根直导管,
故答案为:有;去掉胶塞或将广口瓶的塞子换成双孔塞,另一孔插入一根直导管.
点评 本题考查了探究次氯酸、二氧化硫的漂白性,明确实验原理是解本题关键,根据实验目的进行对比实验,根据物质的性质分析解答,题目难度中等,注意根据电子注意判断I元素在氧化产物中的化合价,是对学生综合能力的考查.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入苯酚显紫色的溶液:K+、NH4+、Cl-、I-;加入酚酞呈红色的溶液:SO42-、K+、Cl-、HSO3-分别都不能大量共存(常温下) | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO2-、CO32-、Na+; pH=2的溶液:NO3-、Fe2+、Na+、Al3+分别都可以大量共存(常温下) | |
| C. | 已知:25℃时,Mg(OH)2的Ksp=5.61×10-12,MgF2的KSP=7.42×10-11,25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2 可以转化为MgF2 | |
| D. | 表示H2燃烧热的化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(1);△H=-285.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
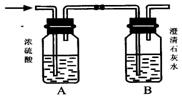 某混合气体X含H2、CO、CH4中的一种或几种组成.将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶.试回答下列问题:
某混合气体X含H2、CO、CH4中的一种或几种组成.将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
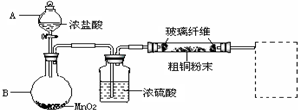
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
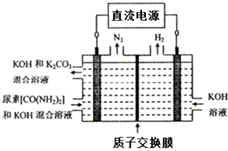 工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].
工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].| 时间/min | 0 | 20 | 70 | 80 | 100 |
| 万(CO2)/mol | 0.10 | 0.060 | 0.020 | 0.020 | 0.020 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
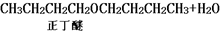
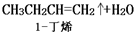
| 化合物 | 密度(g•cm-3) | 水溶性 | 沸点(℃) |
| 冰乙酸 | 1.05 | 易溶 | 118.1 |
| 正丁醇 | 0.80 | 微溶 | 117.2 |
| 正丁醚 | 0.77 | 不溶 | 142.0 |
| 乙酸正丁酯 | 0.90 | 微溶 | 126.5 |
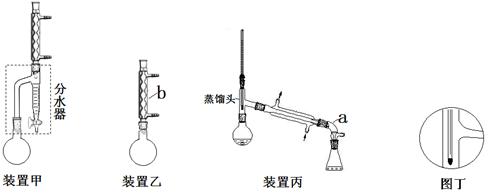


查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com