
| A.电能是一级能源 | B.水力是二级能源 |
| C.天然气是一级能源 | D.焦炉气是一级能源 |
科目:高中化学 来源:不详 题型:单选题
| A.向含有1 mol KAl(SO4)2的溶液中加入Ba(OH)2溶液至沉淀质量最大时,沉淀的总的物质的量为2mol |
| B.裂解、煤的汽化、石油减压分馏、甲苯制TNT等过程中都包含化学变化 |
| C.需要通电才可进行的有:电离、电解、电镀、电化学腐蚀 |
| D.乙醇和丙烯的物质的量均为1mol,完成燃烧消耗的氧气的质量相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.海水中蕴藏有丰富的资源,人类可以大量开发,以弥补资源的短缺 |
| B.海水可以成为廉价的资源基地,但要合理开发,综合利用 |
| C.可以用太阳能电解海水以获取氢能源 |
| D.人类在利用海水时要兼顾海洋生物和海洋生态平衡 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.盐酸 | B.酒精 | C.乙酸 | D.苯 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.制石灰乳:CaO+H2O=Ca(OH)2 第3页(共6页) | |
| B.制Mg(OH)2:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2 | C.制MgCl2:Mg(OH)2+2HCl=MgCl2+2H2O |
| D.制Mg,在MgCl2溶液中加Na:MgCl2+2Na=2NaCl+Mg |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用乙醇和浓硫酸制乙烯 | B.用电解水获得的氢气来合成氨 |
| C.用晒盐后的卤水制溴单质 | D.用氢氧化钠和二氧化碳制碳酸钠 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
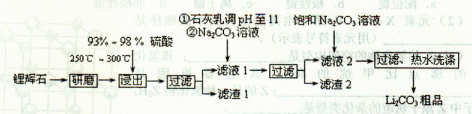
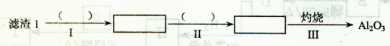
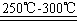 Li2SO4+Al2O3·H2O↓
Li2SO4+Al2O3·H2O↓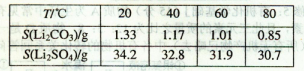
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
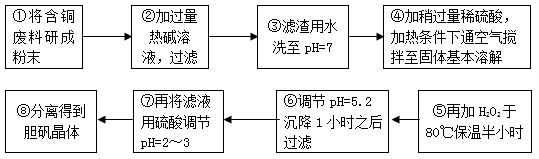
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 | Fe(OH)2 |
| pH | 5.2 | 3.1 | 6.7 | 9.4 | 9.7 |
 。
。 。
。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com