
已知碳碳单键可以绕键轴自由旋转,结构简式为如下图所示的烃,下列说法中正确的是
A.分子中至少有9个碳原子处于同一平面上
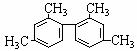 B.分子中至少有10个碳原子处于同一平面上
B.分子中至少有10个碳原子处于同一平面上
C.分子中至少有11个碳原子处于同一平面上
D.该烃属于苯的同系物
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
下列离子组在水溶液中能大量共存,且投入铝有气体生成的是( )
A.NO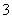 、Cl-、Na+、H+
、Cl-、Na+、H+
B.AlO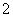 、K+、ClO-、CO
、K+、ClO-、CO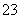
C.Ca2+、Cl-、SO 、Na+
、Na+
D.SO 、Fe2+、OH-、NH
、Fe2+、OH-、NH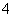
查看答案和解析>>
科目:高中化学 来源: 题型:
苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
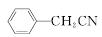 +H2O+H2SO4
+H2O+H2SO4
 +NH4HSO4
+NH4HSO4
 | |||
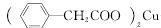 | |||
+Cu(OH)2—→ +H2O
制备苯乙酸的装置示意图如下(加热和夹持装置等略):

已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL 70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是______________________________。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器b的作用是__________;仪器c的名称是__________,其作用是____________。
反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是____________。下列仪器中可用于分离苯乙酸粗品的是____________(填标号)。
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(3)提纯粗苯乙酸的方法是____________,最终得到44 g纯品,则苯乙酸的产率是____________。
(4)用CuCl2·2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是__________________。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30 min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列四种分离乙醇、乙酸的方案中最佳的一组是 ( )
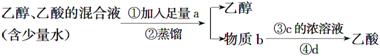
| a | b | c | d | |
| A | Na2CO3饱和溶液 | 乙酸钠 | 硫酸 | 蒸馏 |
| B | Na2CO3固体 | 乙酸钠 | 盐酸 | 过滤 |
| C | CaO固体 | 乙酸钙 | 盐酸 | 过滤 |
| D | CaO固体 | 乙酸钙 | 硫酸 | 蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
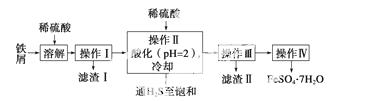
查询资料,得有关物质的数据如下表:
| 25 ℃时 | pH |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
(1)检验制得的绿矾晶体中是否含有Fe3+,最好选用的试剂为________(填字母序号)。
A.KSCN溶液 B.NaOH溶液
C.KMnO4溶液 D.苯酚溶液
(2)操作Ⅱ中,通入硫化氢至饱和的目的是______________________;在溶液中用硫酸酸化至pH=2的目的是____________________。
(3)操作Ⅳ的顺序依次为____________、冷却结晶、___________________________。
(4)操作Ⅳ得到的绿矾晶体用少量冰水洗涤,其目的是①除去晶体表面附着的硫酸等杂质;②__________________________________________________________________。
(5)测定绿矾产品中Fe2+含量的方法:a.称取2.850 g绿矾产品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用硫酸酸化的0.010 00 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL。
①滴定时盛放KMnO4溶液的仪器为________________(填仪器名称)。
②判断此滴定实验达到终点的方法是________________________________________。
③上述样品中FeSO4·7H2O的质量分数为________。(结果保留3位有效数字)(FeSO4·7H2O的相对分子质量为278)
查看答案和解析>>
科目:高中化学 来源: 题型:
萤火虫发光前后物质的变化如下:
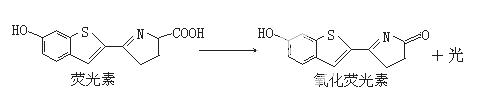
下列关于荧光素和氧化荧光素的叙述不正确的是( )
A. 二者的分子组成相差一个CHO
B.二者的分子组成相差一个CH2O
C.都能使酸性KMnO4溶液褪色
D.都既能发生加成反应又能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
氯碱工业是化学工业的基础,如图为一种降低能耗,充分利用氯碱工业产物的联产示意图。

试回答下列问题:
(1)X气体为________(填化学式)。
(2)写出B中燃料电池负极的电极反应式:____________________。
(3)若用浓硫酸处理钛铁矿,并向所得溶液中加入铁,则此时溶液中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的溶解度(S/mol·L-1)与溶液pH的关系如图所示。将上述处理液加水稀释后, 立即析出大量白色沉淀,写出该反应的离子方程式:_______________。

(4)已知:①Mg(s)+Cl2(g)===MgCl2(s) ΔH=-641 kJ·mol-1
②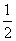 Ti(s)+Cl2(g)===
Ti(s)+Cl2(g)===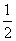 TiCl4(l) ΔH=-385 kJ·mol-1
TiCl4(l) ΔH=-385 kJ·mol-1
写出Mg与TiCl4反应的热化学方程式:_______________,
该反应过程中还应控制的反应条件是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂。
(1)氯化钠电解法是一种可靠的工业生产ClO2方法。
①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO 等杂质。其次除杂操作时,往粗盐水中先加入过量的________(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO
等杂质。其次除杂操作时,往粗盐水中先加入过量的________(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO ,其原因是___________【已知:Ksp(BaSO4)= 1.1 ×10-10 Ksp(BaCO3)= 5.1 ×10-9】
,其原因是___________【已知:Ksp(BaSO4)= 1.1 ×10-10 Ksp(BaCO3)= 5.1 ×10-9】
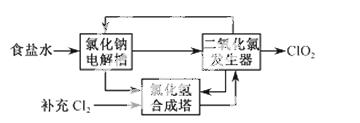
②该法工艺原理如右。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。
工艺中可以利用的单质有____________(填化学式),发生器中生成ClO2的化学方程式为___________。
(2)纤维素还原法制ClO2是一种新方法,其原理是:纤维素水解得到的最终产物D与NaClO3反应生成ClO2。完成反应的化学方程式:
□ (D) +24NaClO3+12H2SO4=□ClO2↑+□CO2↑+18H2O+□_________
(3)ClO2和Cl2均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-。处理含CN-相同量得电镀废水,所需Cl2的物质的量是ClO2的_______倍
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于混合物与纯净物的微观解释不正确的是( )
A、混合物是由多种微粒构成的
B、纯净物是由一种微粒构成的
C、混合物中各物质的微粒相互间不发生反应
D、混合物中各物质的微粒不再保持各自的化学性质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com