
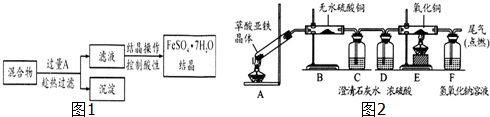
分析 (1)加入过量的铁粉,与Fe3+、Cu2+、H+离子反应转化为Fe2+;过滤使用的主要玻璃仪器是普通漏斗;
(2)趁热过滤的目的是:要避免某些成分在过滤过程中因遇冷而结晶或沉淀;
(3)应从盐类水解的角度考虑,防止硫酸亚铁水解造成损耗;
(4)由题意可知(NH4)2Fe(SO4)2与草酸反应的方程式:(NH4)2Fe(SO4)2+H2C2O4=FeC2O4↓+(NH4)2SO4+H2SO4;
(5)草酸亚铁晶体加热时有可能有水产生,故A装置最不合理,因为大试管管口略向上倾斜,产生的水会回流使试管炸裂,根据B、C、E判断产物有H2O(或结晶水)、CO2、CO,其中CO的存在使高价铁不可能存在,考虑残留黑色固体,应为FeO,设草酸亚铁晶体的化学式为FeC2O4•xH2O,根据FeC2O4•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO+CO2+xH2O,结合晶体和氧化亚铁的质量可计算出x的值,确定化学式.
解答 解:(1)加入过量的铁粉,与Fe3+、Cu2+、H+离子反应转化为Fe2+;过滤使用的主要玻璃仪器有:烧杯、玻璃棒、普通漏斗,
故答案为:Fe;漏斗;
(2)趁热过滤的目的是:要避免某些成分在过滤过程中因遇冷而结晶或沉淀,
故答案为:防止硫酸亚铁晶体析出;
(3)亚铁离子可以水解,结晶操作过程中控制滤液的酸性,可以抑制硫酸亚铁水解造成损耗,
故法案为:抑制Fe2+离子水解;
(4)由题意可知(NH4)2Fe(SO4)2与草酸反应的方程式:(NH4)2Fe(SO4)2+H2C2O4=FeC2O4↓+(NH4)2SO4+H2SO4,故反应离子方程式为:Fe2++H2C2O4=FeC2O4↓+2H+,
故答案为:Fe2++H2C2O4=FeC2O4↓+2H+;
(5)①加热固体时可能有水产生,故A装置最不合理,因为大试管管口略向上倾斜,产生的水会回流使试管炸裂,
故答案为:A;反应生成的水易沿试管壁流下使试管炸裂;
②改用正确装置,实验开始后,B处变蓝色,说明草酸亚铁晶体中有结晶水;C处有白色沉淀,E处部分黑色粉末变为红色,说明草酸亚铁分解产生:CO、CO2;CO的存在使高价铁不可能存在,考虑残留黑色固体,应为FeO,
设草酸亚铁晶体的化学式为FeC2O4•xH2O,
根据FeC2O4•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO+CO2+xH2O
144+18x 72
18 7.2
$\frac{144+18x}{18}$=$\frac{72}{7.2}$ x=2,
所以草酸亚铁晶体的化学式为FeC2O4•2H2O,
故答案为:结晶水;CO、CO2;FeC2O4•2H2O.
点评 本题以硫酸亚铁晶体的制备为载体,主要考查了除杂提纯的基本操作、对实验步骤原理和目的分析评价、对装置的分析评价等,明确原理是解题关键,弄清所发生的化学反应及铁元素存在形态的变化.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原混合气体的体积为1.2V L | B. | 原混合气体的体积为1.1V L | ||
| C. | 反应达平衡时气体A消耗掉0.05V L | D. | 反应达平衡时气体B消耗掉0.05V L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+C12$\stackrel{光}{→}$CH3Cl+HCl | B. | CH2=CH2+C12→ | ||
| C. |  +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$ +HBr +HBr | D. | CH4+2O2 $\stackrel{点燃}{→}$CO2+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com