
| A. | 向水中加入KHSO4溶液,平衡逆向移动,Kw减小 | |
| B. | 将水加热,Kw增大,pH减小 | |
| C. | 向水中加入少量固体CH3COONa平衡逆向移动,c(H+)降低 | |
| D. | 向水中加入AlCl3溶液,平衡向右移动,KW增大 |
分析 根据水的电离方程式知,向水中加入酸或碱抑制水电离,加入含有弱根离子的盐能促进水电离,水的离子积常数只与温度有关.
解答 解:A、温度不变,水的离子积常数不变,与溶液的酸碱性无关,故A错误;
B、水的电离是吸热反应,升高温度促进水电离,离子积常数增大,氢离子浓度增大,溶液的pH减小,故B正确;
C、CH3COONa是强碱弱酸盐,在溶液能结合水电离出氮气氢离子从而使水的电离被促进,故向水中加入醋酸钠固体,促进水电离,平衡正向移动,氢离子浓度减小,故C错误;
D、AlCl3是强酸弱碱盐,在水溶液中能结合水电离出的氢氧根而水解,从而对水的电离有促进作用,即水的电离向右移,但由于温度不变,故Kw不变,故D错误.
故选B.
点评 本题考查水的电,离,酸、碱和含有弱根离子的盐能影响水电离,但不影响离子积常数,为易错点.


 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:填空题
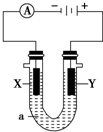 X、Y都是惰性电极,a是饱和NaCl溶液.
X、Y都是惰性电极,a是饱和NaCl溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 三氯化铁溶液中加入铁粉:2Fe3++Fe═3Fe2+ | |
| D. | 铜片放入稀硝酸中产生气体:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠能与水反应生成碱,但过氧化钠不是碱性氧化物 | |
| B. | 检验FeCl3溶液中的少量Fe2+,可以用KSCN溶液 | |
| C. | SiO2既能和氢氧化钠溶液反应又能和氢氟酸反应,所以是两性氧化物 | |
| D. | 普通玻璃是纯净物,其组成可用Na2O•CaO•6SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2与水反应 | B. | SO2与H2S溶液反应 | ||
| C. | SO2与NaOH溶液反应 | D. | SO2与酸性高锰酸钾溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
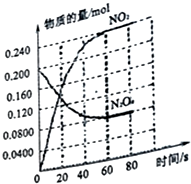 在容积为2.0L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体颜色变深.回答下列问题:
在容积为2.0L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体颜色变深.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a、b不可能是同种材料的电极 | |
| B. | 该装置可能是原电池,也可能是电解池 | |
| C. | 该装置可能是原电池,电解质溶液为稀硝酸 | |
| D. | 该装置的电极可以是铜锌,电解质溶液是稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
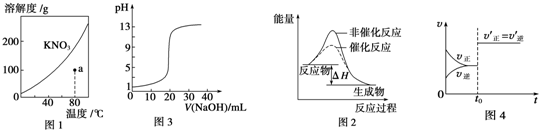
| A. | 图1表示KNO3的溶解度曲线,图中a点对应的溶液是80℃时KNO3的饱和溶液 | |
| B. | 图2表示某吸热热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| C. | 图3表示0.1000 mol•L-1 NaOH溶液滴定20.00 mL 0.1000 mol•L-1醋酸溶液的滴定曲线 | |
| D. | 图4表示t0时改变的条件可能是增大压强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com